Автор: Трубачева Е.С., врач – клинический фармаколог
Завершая тему базовых знаний, которые потребуются для дальнейшего предметного разговора, поговорим о микробиологической диагностике, так как понять, а не зазубрить антибактериальную терапию без знаний микробиологии физически не возможно. До тех пор, пока вы не подружились с этим разделом медицины, АБТ будет темным и непролазным лесом.
Для чего нам нужны знания в области микробиологии? Во-первых, врага надо знать в лицо и вообще понимать, кто нам враг, а кто просто сосед, а то и друг, выполняющий массу полезных функций, ибо наличие микроба не равно наличию возбудителя, так как люди в принципе далеки от стерильности (за исключением таких закрытых систем, как кровь и спинно-мозговая жидкость, которые в норме стерильны). Во-вторых, понимать, чем мы можем истребить возбудителя с минимальным ущербом для пациента (смотрим пункт «антибактериальная активность» в главе «Азы» и главу «Безопасность»). В-третьих, зная пути распространения возбудителей, можем в дальнейшем не допустить уже внутрибольничное заражение и как следствие вспышку нозокомиальных инфекций. В-четвертых, как от всего этого защитить себя и своих близких, так как медицинский персонал вообще и врачи в частности являются основными источниками внутрибольничной флоры, и, если ваш близкий попадает в больницу, свой профессиональный статус надо озвучить в интересах больного, так как он может также оказаться носителем устойчивой к антибиотикам микрофлоры. Именно для этого нам нужны микробиологические знания, микробиологическая диагностика вообще и микробиологическая лаборатория в близком доступе в частности.
Итак, с чего мы начнем? Конечно с процесса диагностики.
С чего начинается диагностический процесс? С правильного забора патологического материала. Материал собирается строго до начала антибактериальной терапии, ибо даже единственная доза антибиотика способна нанести непоправимый (в плане диагностического поиска) удар по микробной популяции и вместо истинного возбудителя можно набрать ни в чем не повинных сапрофитов. Разработаны достаточно подробные правила, как это делать, например, можно ознакомиться тут – http://www.antibiotic.ru/cmac/pdf/6_2_143.pdf, за прошедшие годы почти ничего не изменилось, и написано на редкость читабельным языком, так что не хотелось бы плагиатить.
На чем бы хотелось отдельно заострить внимание – если ведется забор материала из гнойной раны, ни в коем случае нельзя забирать гнойное содержимое, так как таким образом вы собираете, дохлых, простите, нейтрофилов и макрофагов. А так как диагностический забор проводится строго до начала антибактериальной терапии, то шанс на правильную детекцию может быть безвозвратно потерян. Поэтому лучше всего брать либо поврежденную ткань, если имеется такая возможность, либо собирать материал на тампон с краев раны (при ее наличии) или с поврежденной ткани.
После забора материала, в идеале, его сразу же необходимо доставить в лабораторию, но мы живем в реальном мире, и хорошо, если на следующее утро пробирки и флаконы туда доедут. Поэтому помимо правильного забора должно быть правильное хранение в коммерческих флаконах на транспортных средах и при правильных температурных условиях. Такие данные производители подобной тары тщательно оформляют, надо только ознакомиться с соответствующей документацией, которая приходит вместе с ней по окончании ежегодных торгов. Нет, все подряд ставить и хранить в холодильнике нельзя, не все микробы там выживают, и в итоге вместо возбудителя, упокоившегося с миром при +4°C, лаборатория выдаст совершенно не имеющего отношения к патологическому процессу сапрофита, или того хуже, контамината. А собранная на микробиологию моча на подоконнике – это прямой путь к вторичному загрязнению образцов и пойди-пойми, что было первым. Так что повторюсь – всегда надо читать документацию по тем флаконам и средам, что отыгрываются на ежегодных аукционах. Или прочитать статью по вышеуказанной ссылке.
Что делать, пока материал добирается до лаборатории? Как уже говорилось в главе об «Азах» – использовать эмпирическую терапию, а чтобы уж совсем не брести по дебрям даже с путеводителем в виде толкового справочника в кармане, для некоторых стандартных ситуаций можно использовать коммерческие экспресс-тесты, типа «Стрептатеста» для определения БГСА при остром тонзиллите или тест для определения антигена S. pneumoniae в моче у пациентов с пневмонией (который, к слову, входит в стандарты выявления пневмококковой пневмонии в России), или тест на определение гриппа А или В – и подобных тестов множество, просто о них надо знать. Преимущества подобной диагностики озвучивать не надо, они очевидны – в течение в среднем 15 минут мы получаем достаточно точный (так как чувствительность и специфичность такого рода диагностики высокие) ответ, с каким возбудителем имеем дело и потребуется ли антибактериальная терапия вообще, что, согласитесь, и очень удобно, и информативно, единственная проблема состоит в том, что это все же больше амбулаторный вариант применения, хотя для первичной диагностики вполне может быть использован и в стационарах на уровне приемника.
Или использовать второй вариант, который возможен только в условии стационара с собственной микробиологической лабораторией, а именно мазок по Граму, когда в течение 1 часа (если учитывать время доставки материала и время ответа) вы будете точно знать, с какой флорой имеете дело – грам-положительной или грам-отрицательной. Почему это важно? Потому что за крайне редким исключением (например, карбопенемы) у каждого антибиотика своя специализация, например, цефазолин – один из самых эффективных препаратов против грам-положительного мецитилинчувствительного золотистого стафилококка, а цефтриаксон, обладающий преимущественно грам-отрицательной антивностью, против этой зверушки совершенно бессилен. Вновь отправляю вас к обсуждению антимикробной активности в главе «Азы»
Есть и третий вариант, если вдруг вы работаете в медицинском центре, оснащенном по последнему слову техники, и в лаборатории стоит масс-спектрометр, который за тот же самый час выдаст имя и фамилию возбудителя, правда с отчеством, точнее с антибиотикочувствительностью, все равно придется ждать минимум 48 часов.
Следующим этапом диагностического процесса будет работа микробиологической лаборатории по детекции возбудителя и такой обязательный этап, как определение антибиотикочувствительности. Если с самим процессом выращивания микробов на питательных средах нам более-менее все ясно со времен курса микробиологии в медицинском ВУЗе, то с определением чувствительности могут возникнуть затруднения.
Что нам необходимо знать об этом процессе? Во-первых, чем именно работает ваша лаборатория – диско-диффузионным методом (ДДМ), Е-тестами или в ее оснащении имеются автоматизированные системы для определения антибиотикочувствительности. В условиях первичного звена ДДМ более чем достаточно, так как откровенно резистентные возбудители здесь достаточно редки (в исключения попадут возбудители ЗППП и, возможно, пневмококк, но о нем мы поговорим отдельно), а методика технически не сложна и, что в наше время немаловажно, не дорога в финансовом плане. Но у него есть очень существенный недостаток – время! Пациент уже давно выписался, а результат только-только приходит, согласитесь, для стационаров с их контингентом это очень неприятно, если не сказать, неприемлемо, поэтому для них нужны автоматизированные системы определения антибиотикочувствительности или, на крайний случай, Е-тесты, но не могу сказать, что они сильно дешевле. Почему это важно? Во-первых, скорость определения возбудителя и его устойчивости. Она как раз успевает к тем самым 48 часам (о которых мы говорили в «Азах»), когда мы принимаем решение об эффективности или неэффективности эмпирической АБТ. Во-вторых, данные методы детекции не просто отвечают нам на вопрос, устойчив микроб к антибиотикам или чувствителен (R или S в бланке ответа), а указывают его минимальную подавляющую концентрацию (МПК или MIC), что крайне важно и для понимания, дикий перед нами зверь или внутрибольничный возбудитель (ДДМ нам на это только намекнет), и, в случае дозозависимых антибиотиков, которые мы упоминали в главе «Азы», поможет рассчитать необходимую дозировку препарата, а также, что чуть ли не самое главное в условиях стационара, поможет понять, откуда сей зверь вообще взялся в случае внутрибольничного заражения.
Приведу пример: допустим, у вас в стационаре ведется плановый микробиологический мониторинг, и в одном из отделений постоянно высевается некий возбудитель как постоянный житель. И вдруг этот же микроб посеялся не то что в другом отделении, а вообще в другом корпусе. Мы уже упоминали, что у внутрибольничной флоры ножек нет, пешком она не ходит и, как не сложно это признавать, носим эту самую флору мы – медицинский персонал, на своих руках, в носах, волосах, бородах и вообще всем том, что может с пациентом сконтактировать. Так вот, подобные анализы в ходе проведения эпидемиологического расследования помогут специально обученному человеку (эпидемиологу или клиническому фармакологу, или им обоим) обрубить путь такого переноса и инфицирования пациентов в стационаре, обеспечивая безопасность как пациентам, так и врачам, которые будут иметь возможность спокойно проводить необходимые манипуляции без риска внутрибольничного инфицирования и угрозы потерять плоды трудов своих. А уж в нынешних условиях, когда грозятся еще и за ВБИ ввести тяжкую статью в УК (и надо понимать, что любая ВБИ – это изначально самая настоящая ятрогения, от которой очень высокая летальность), актуальность подобных исследований и мониторингов возрастает на порядки.
Следующий и, по сути, последний этап применения микробиологических знаний. Лаборатория прислала результат, и нам надо его как-то прочитать и понять. В случае ДДМ нам дадут только набор букв R (устойчивый) и S (чувствительный). В случае дикого, но крайне симпатичного, возбудителя он согласно профилю (грам-плюс или грам-минус) будет чувствителен практически ко всему набору тестируемых антибиотиков, останется выбрать то, что вам милее, дешевле и соответствует текущим на данный период времени клиническим рекомендациям и антимикробной активности антибиотиков.
Дикий и очень симпатичный штамм некоего грам-отрицательного возбудителя, определенный методом автоматической детекции, может выглядеть так (рисунок 1). Как вы видите, зверь совершенно не пуганный, а больной, с высокой долей вероятности, приблизительно полгода, а скорее всего год антибиотики не видел.
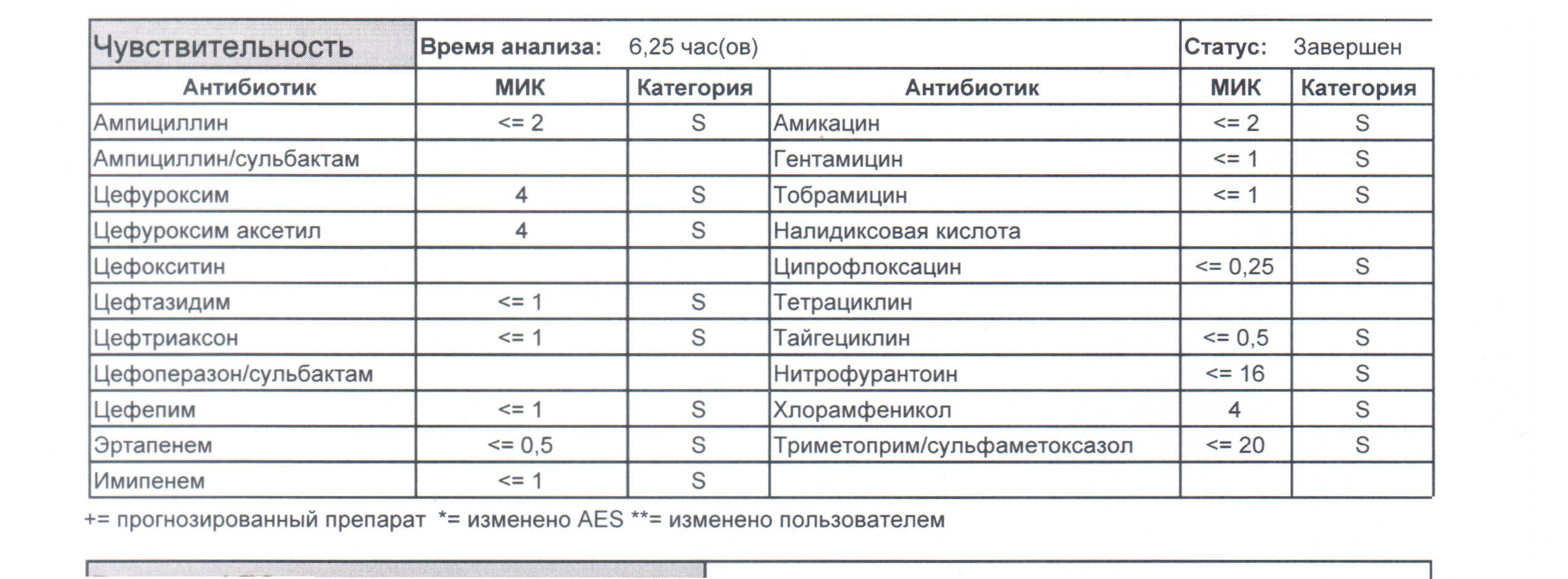
(рисунок 1)
А это результат посева от пациента, чьего возбудителя (того же самого, что и в первом случае) уже успели потравить, в данном случае цефтриаксоном (рисунок 2), что помимо выработки устойчивости к этому препарату, привело к образованию штамма, обладающего бета-лактамазами расширенного спектра, и работать группой бета-лактамов (а именно пенициллинами и цефалоспоринами) будет невозможно – возбудитель их разрушит. Причем, обратите внимание, цефтриаксонили пациента от души, даже к цефтазидиму, для которого нужна отдельная бета-лактамаза, начала вырабатываться устойчивость, и даже он ситуацию спасти не сможет. Но мы отдельно поговорим, чем такого зверя можно убить, когда будем обсуждать его отдельно.
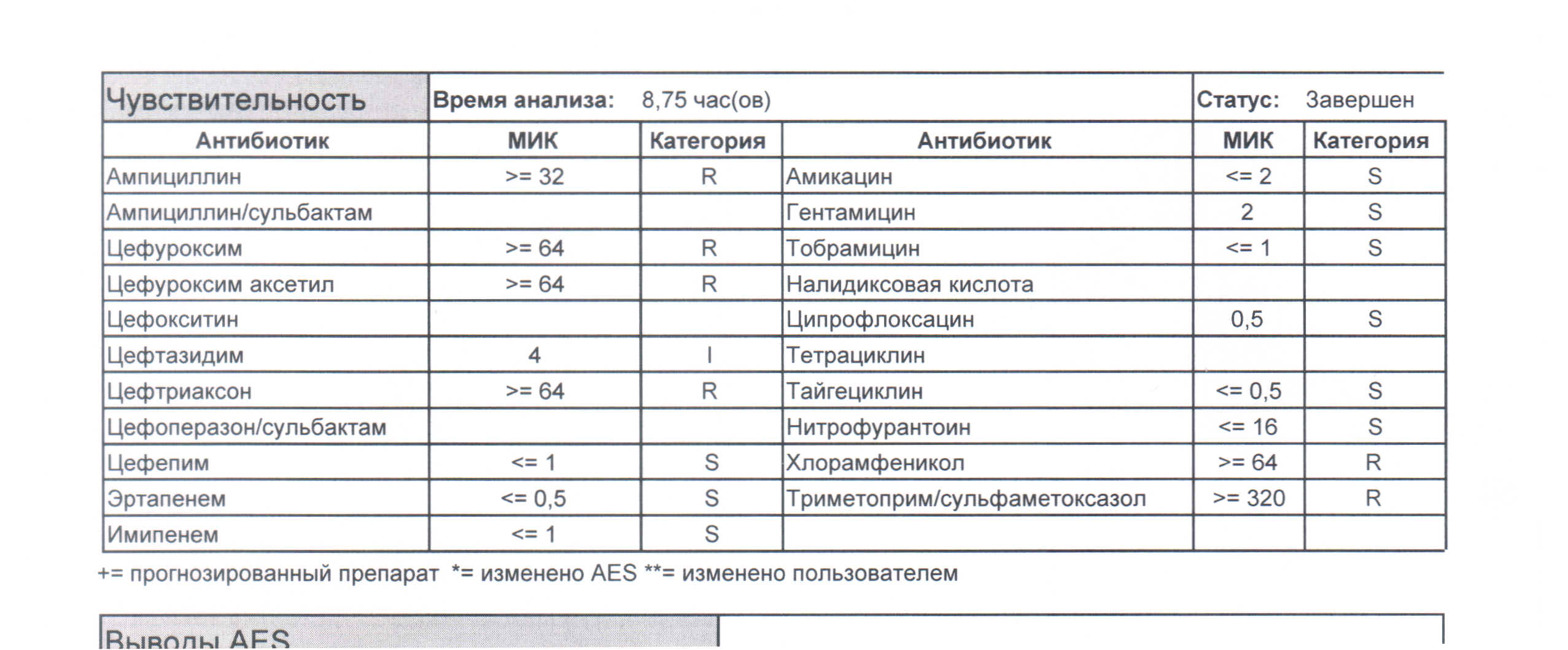
(рисунок 2)
И третий вариант этого же самого возбудителя, но уже в виде штамма, вооруженного до зубов (рисунок 3). Это уже исключительно нозокомиальный возбудитель, такого с улицы не принесут, так как это житель стационаров (если только из другого стационара пациента переведут), а значит, в пациенте он оказался только с помощью чьих-то не мытых по протоколу рук. Это чистая ятрогенная инфекция, определять которую научилось как минимум ФСБ, желающие могут ознакомиться с делом хабаровского кардиоцентра (сразу скажу, персонал не пострадал, так как пробой был на уровне администрации, начмед-эпидемиолог-бактериолог, занимавшиеся фальсификациями и не занимавшиеся прямыми обязанностями по обеспечению сан-эпид режима, но кто сказал, что в следующий раз так повезет?). Главная проблема этого возбудителя еще и в том, что он умеет передавать свои гены устойчивости такой же грам-отрицательной флоре, а истребить его в стационаре физически невозможно, так как для этого придется истреблять еще и медицинский персонал. Так что в данной ситуации не инфицировать пациентов можно только единственным способом – соблюдением правил СанПин, а именно Санитарно-эпидемиологические правила и нормативы СанПиН 2.1.3.2630-10 "Санитарно-эпидемиологические требования к организациям, осуществляющим медицинскую деятельность" (утв. постановлением Главного государственного санитарного врача РФ от 18 мая 2010 г. N 58), которые пока еще не обновлены и которые в распечатанном виде находятся у каждой старшей сестры отделения. Либо можно ознакомиться тут – http://docs.cntd.ru/document/902217205.
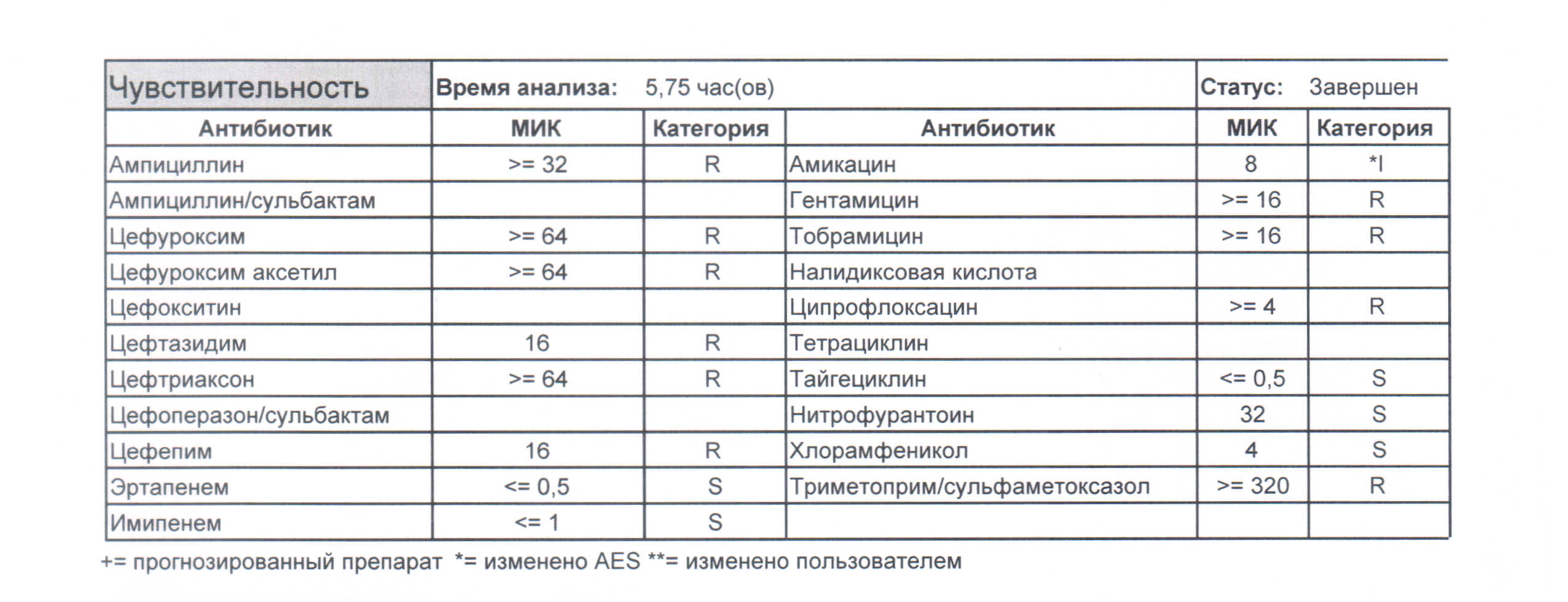
(рисунок 3)
Как вы понимаете, при появлении подобных штаммов никакой ДДМ не поможет, здесь необходима точная детекция в лаборатории и консультация специально-обученного АБТ, микробиологии и эпид.надзору человека – клинфарма проще говоря, так как вопросы лечения будут отнюдь не справочными и должны учитывать множество составляющих. Это в чистом и незамутненном виде индивидуализированная медицина, для которой пока нет ни справочников, ни методичек, так как в каждом конкретном случае ситуация будет очень и очень индивидуальной.
Мы далее, когда будем обсуждать отдельных возбудителей, проговорим особые случаи остро-значимых резистентных возбудителей и способы борьбы с ними (не у всех же в штате имеются клинфармы-антибиологи). А пока можно ознакомиться с таким полезным ресурсом, как база данных по антибиотико-чувствительности EUCAST (https://mic.eucast.org/Eucast2/SearchController/search.jsp?action=init) позволяющая осуществлять поиск как по возбудителю, так и по антибиотику для изучения точек отсечения, когда возбудитель теряет клиническую чувствительность к препарату и становится устойчивым на основании данных MIC.
Например, данные по чувствительности Acinetobacter calcoaceticus (к сожалению, теперь уже очень частому жителю реанимаций) к ципрофлоксацину. При MIC равном 2 он переходит в разряд резистентных и использование ципрофлоксацина будет неверным.
ципрофлоксацину" src="/upload/kcfinder/files/Image/microbiology%20pic4.jpg" style="height:416px; width:520px" />
Может возникнуть логичный вопрос – зачем нам иностранный ресурс, когда есть наш до сих пор действующий МУК 4.2.1890-04 (http://www.antibiotic.ru/cmac/pdf/6_4_306.pdf)»? Приведу цитату Козлова Р. С. как ответ на похожий вопрос: «В основе современных российских клинических рекомендаций лежат рекомендации Европейского комитета по определению чувствительности (EUCAST).» http://www.antibiotic.ru/minzdrav/faq/
В данный момент переводы документов EUCAST выкладываются по этой ссылке http://www.antibiotic.ru/iacmac/ru/info/eucast.shtml, использование которых абсолютно правомочно, но для неподготовленного пользователя будет создавать серьезные сложности.
В заключение нашего краткого экскурса в микробиологическую составляющую АБТ, которую мы, конечно, расширим и углубим в дальнейших беседах, хотелось бы повториться, что без микробиологии в вопросах АБТ мы никуда не уедем, если действительно хотим ее понимать, поэтому дальнейшее погружение в тему будет происходить сквозь призму наиболее часто встречающихся возбудителей. А если будет желание покопать эту тему отдельно и более прицельно, то существует совершенно замечательный и не менее убийственный трехтомник «Медицинская микробиология» под редакцией Лабинской, состоящий из четырех книг и весящий как малая медицинская энциклопедия. Лучше на русском языке не написал никто, но она для очень продвинутого в теме читателя, хотя если возникнет интерес, с этим изданием точно стоит ознакомиться.




