Инсудайв® Слим (Insudive Slim) инструкция по применению
- 📜 Инструкция по применению Инсудайв® Слим
- 💊 Состав препарата Инсудайв® Слим
- ✅ Применение препарата Инсудайв® Слим
- 📅 Условия хранения Инсудайв® Слим
- ⏳ Срок годности Инсудайв® Слим
Владелец регистрационного удостоверения:
Лекарственные формы
|
|
Инсудайв® Слим |
Раствор для подкожного введения 0.25 мг/доза: шприц-ручка 1.5 мл
рег. №: ЛП-(010983)-(РГ-RU)
от 18.07.25
- Действующее
Дата переоформления: 10.10.25
|
|
Раствор для подкожного введения 0.5 мг/доза: шприц-ручка 1.5 мл
рег. №: ЛП-(010983)-(РГ-RU)
от 18.07.25
- Действующее
Дата переоформления: 10.10.25
|
||
|
Раствор для подкожного введения 1 мг/доза: шприц-ручка 3 мл
рег. №: ЛП-(010983)-(РГ-RU)
от 18.07.25
- Действующее
|
||
|
Раствор для подкожного введения 1.7 мг/доза: шприц-ручка 3 мл
рег. №: ЛП-(010983)-(РГ-RU)
от 18.07.25
- Действующее
|
||
|
Раствор для подкожного введения 2.4 мг/доза: шприц-ручка 3 мл
рег. №: ЛП-(010983)-(РГ-RU)
от 18.07.25
- Действующее
|
Форма выпуска, упаковка и состав препарата Инсудайв® Слим
Раствор для п/к введения, 0.25 мг/доза, бесцветный или со слегка коричневатым оттенком, прозрачный.
| 1 мл | 1 шприц-ручка (1.5 мл)* | |
| семаглутид | 0.68 мг | 1 мг |
* Каждая предварительно заполненная шприц-ручка содержит 1 мг семаглутида в 1.5 мл раствора препарата, что соответствует 4 дозам по 0.25 мг семаглутида.
Вспомогательные вещества: динатрия гидрофосфата дигидрат, пропиленгликоль, фенол, хлористоводородная кислота (для коррекции pH), натрия гидроксид (для коррекции pH), вода д/и.
1.5 мл (4 дозы по 0.25 мг семаглутида) - картриджи, встроенные в шприц-ручки одноразовые мультидозовые для многократных инъекций (1) с 4 иглами одноразовыми - пачки картонные×.
Раствор для п/к введения, 0.5 мг/доза, бесцветный или со слегка коричневатым оттенком, прозрачный.
| 1 мл | 1 шприц-ручка (1.5 мл)** | |
| семаглутид | 1.34 мг | 2 мг |
** Каждая предварительно заполненная шприц-ручка содержит 2 мг семаглутида в 1.5 мл раствора препарата, что соответствует 4 дозам по 0.5 мг семаглутида.
Вспомогательные вещества: динатрия гидрофосфата дигидрат, пропиленгликоль, фенол, хлористоводородная кислота (для коррекции pH), натрия гидроксид (для коррекции pH), вода д/и.
1.5 мл (4 дозы по 0.5 мг семаглутида) - картриджи, встроенные в шприц-ручки одноразовые мультидозовые для многократных инъекций (1) с 4 иглами одноразовыми - пачки картонные×.
Раствор для п/к введения, 1 мг/доза, бесцветный или со слегка коричневатым оттенком, прозрачный.
| 1 мл | 1 шприц-ручка (3 мл)□ | |
| семаглутид | 1.34 мг | 4 мг |
□ Каждая предварительно заполненная шприц-ручка содержит 4 мг семаглутида в 3 мл раствора препарата, что соответствует 4 дозам по 1 мг семаглутида.
Вспомогательные вещества: динатрия гидрофосфата дигидрат, пропиленгликоль, фенол, хлористоводородная кислота (для коррекции pH), натрия гидроксид (для коррекции pH), вода д/и.
3 мл (4 дозы по 1 мг семаглутида) - картриджи, встроенные в шприц-ручки одноразовые мультидозовые для многократных инъекций (1) с 4 иглами одноразовыми - пачки картонные×.
Раствор для п/к введения, 1.7 мг/доза, бесцветный или со слегка коричневатым оттенком, прозрачный.
| 1 мл | 1 шприц-ручка (3 мл)□□ | |
| семаглутид | 2.27 мг | 6.8 мг |
□□ Каждая предварительно заполненная шприц-ручка содержит 6.8 мг семаглутида в 3 мл раствора препарата, что соответствует 4 дозам по 1.7 мг семаглутида.
Вспомогательные вещества: динатрия гидрофосфата дигидрат, пропиленгликоль, фенол, хлористоводородная кислота (для коррекции pH), натрия гидроксид (для коррекции pH), вода д/и.
3 мл (4 дозы по 1.7 мг семаглутида) - картриджи, встроенные в шприц-ручки одноразовые мультидозовые для многократных инъекций (1) с 4 иглами одноразовыми - пачки картонные×.
Раствор для п/к введения, 2.4 мг/доза, бесцветный или со слегка коричневатым оттенком, прозрачный.
| 1 мл | 1 шприц-ручка (3 мл)□□□ | |
| семаглутид | 3.2 мг | 9.6 мг |
□□□ Каждая предварительно заполненная шприц-ручка содержит 9.6 мг семаглутида в 3 мл раствора препарата, что соответствует 4 дозам по 2.4 мг семаглутида.
Вспомогательные вещества: динатрия гидрофосфата дигидрат, пропиленгликоль, фенол, хлористоводородная кислота (для коррекции pH), натрия гидроксид (для коррекции pH), вода д/и.
3 мл (4 дозы по 2.4 мг семаглутида) - картриджи, встроенные в шприц-ручки одноразовые мультидозовые для многократных инъекций (1) с 4 иглами одноразовыми - пачки картонные×.
× На пачку может быть нанесена этикетка контроля первого вскрытия.
Фармакологическое действие
Механизм действия
Семаглутид представляет собой аналог ГПП-1, имеющий 94% гомологичности с человеческим ГПП-1. Семаглутид действует как агонист ГПП-1Р, который избирательно связывается с ГПП-1Р (мишенью нативного ГПП-1) и активирует его.
ГПП-1 является физиологическим регулятором аппетита и потребления калорий. Рецепторы ГПП-1 локализуются в различных областях головного мозга, участвующих в регуляции аппетита.
Исследования на животных показали, что семаглутид воздействует на ЦНС через ГПП-1Р. Семаглутид оказывает прямое воздействие на участки головного мозга, участвующие в гомеостатической регуляции потребления пищи в гипоталамусе и стволе мозга. Семаглутид может влиять на ощущение удовольствия от употребления пищи (гедонистическую регуляцию пищевого поведения) через прямое или опосредованное воздействие на структуры головного мозга, включая перегородку, таламус и миндалевидное тело.
КИ показали, что семаглутид снижает потребление калорий, усиливает чувство сытости, насыщения и контроля за приемом пищи, уменьшает чувство голода, а также частоту и интенсивность тяги к еде. Кроме того, семаглутид снижает предпочтение пищи с высоким содержанием жиров.
Семаглутид влияет на гомеостатическую и гедоническую регуляцию пищевого поведения, посредством снижения аппетита, тяги к потреблению калорийной пищи, удовольствия от потребления пищи и изменения пищевых предпочтений.
Кроме того, в КИ было показано, что семаглутид снижает уровень глюкозы в крови посредством глюкозозависимой стимуляции секреции инсулина и снижения секреции глюкагона при повышенном уровне глюкозы в крови. Механизм снижения уровня глюкозы в крови также включает незначительную задержку опорожнения желудка на ранней стадии после приема пищи. Во время гипогликемии семаглутид снижает секрецию инсулина и не влияет на секрецию глюкагона.
Рецепторы ГПП-1 также представлены в сердце, сосудистой системе, иммунной системе и почках. В КИ семаглутид оказывал благоприятное влияние на уровень липидов в плазме крови, снижал систолическое артериальное давление и уменьшал воспаление.
Исследования на животных показали, что семаглутид подавляет развитие атеросклероза и оказывает противовоспалительное действие на сердечно-сосудистую систему.
Фармакодинамические эффекты
Аппетит, потребление калорий и выбор продуктов питания
Семаглутид снижает аппетит, усиливая чувство сытости, одновременно снижая чувство голода и предполагаемое потребление пищи. В ходе исследования 1 фазы потребление калорий во время приема пищи в неограниченном количестве было на 35% ниже при приеме семаглутида по сравнению с плацебо после 20 недель приема. Это было подтверждено улучшением контроля за приемом пищи, уменьшением тяги к еде и относительным снижением предпочтения пищи с высоким содержанием жиров. В исследовании STEP 5 тягу к еде более подробно оценивали с помощью опросника по контролю питания (CoEQ). На 104-й неделе полученные результаты показали значительное улучшение в группе терапии семаглутидом, как в отношении контроля аппетита, так и в отношении тяги к соленой и острой пище, в то время как в отношении тяги к сладкой пище выраженного эффекта не наблюдалось.
Уровень липидов натощак и после приема пищи
Семаглутид в дозе 1 мг по сравнению с плацебо снижал концентрацию триглицеридов натощак и липопротеидов очень низкой плотности (ЛПОНП) на 12% и 21% соответственно. Уровень триглицеридов и ЛПОНП после приема пищи у пациентов при приеме пищи с высоким содержанием жира снижался более чем на 40%.
Клиническая эффективность и безопасность
Эффективность и безопасность семаглутида для снижения массы тела в сочетании со снижением потребления калорий и повышением физической активности оценивались в четырех двойных слепых рандомизированных плацебо-контролируемых исследованиях фазы 3а продолжительностью 68 недель (STEP 1-4). Всего в исследования были включены 4684 взрослых пациента (2652 из них были рандомизированы для лечения семаглутидом).
Кроме того, в ходе двойного слепого рандомизированного плацебо-контролируемого исследования фазы 3b (STEP 5), включавшего 304 пациента (152 пациента принимали семаглутид) были оценены эффективность и безопасность применения семаглутида по сравнению с плацебо в течение 2 лет.
Было продемонстрировано превосходство терапии семаглутидом, клинически значимое и устойчивое снижение массы тела по сравнению с плацебо у пациентов с ожирением (ИМТ > 30 кг/м2) или избыточной массой тела (ИМТ от > 27 кг/м2 до < 30 кг/м2) и, по крайней мере, одним сопутствующим заболеванием, связанным c избыточной массой тела. Кроме того, во всех исследованиях семаглутид позволил пациентам добиться снижения массы тела на > 5%, > 10%, > 15% и > 20% по сравнению с плацебо. Снижение массы тела происходило независимо от наличия желудочно-кишечных симптомов, таких как тошнота, рвота или диарея.
Лечение семаглутидом также показало статистически значимое уменьшение окружности талии, улучшение показателей систолического артериального давления и физического состояния по сравнению с плацебо.
Эффективность была продемонстрирована независимо от возраста, пола, расы, этнической принадлежности, исходной массы тела, ИМТ, наличия СД2 и уровня функции почек.
Различия в эффективности наблюдались во всех подгруппах. Относительно больший эффект снижения массы тела наблюдался у женщин и пациентов без СД2, а также у пациентов с исходно более низкой массой тела по сравнению с пациентами с исходно более высокой массой тела.
STEP 1: Контроль массы тела
В ходе 68-недельного двойного слепого исследования 1961 пациентов с ожирением (ИМТ > 30 кг/м2) или избыточной массой тела (ИМТ от > 27 кг/м2 до < 30 кг/м2) и, по крайней мере, одной сопутствующей патологией, связанной с избыточной массой тела, были рандомизированы в группы с применением семаглутида или плацебо. Все пациенты на протяжении всего исследования соблюдали низкокалорийную диету и повышенную физическую активность.
Снижение массы тела произошло быстро и продолжалось на протяжении всего исследования. К концу лечения (68-я неделя) снижение массы тела в группе семаглутида превосходило и было клинически значимым по сравнению с группой плацебо (см. таблицу 1 и рисунок 1). На фоне терапии семаглутидом пациентам удалось добиться снижения массы тела на > 5%, > 10%, > 15% и на > 20% по сравнению с группой плацебо (см. Таблицу 1 и Рисунок 1). У большей части пациентов с предиабетом в начале исследования в конце лечения семаглутидом уровень гликемии был нормальным по сравнению с плацебо (84.1% против 47.8%).
Таблица 1. STEP 1 результаты на 68-й неделе
| Параметры | Семаглутид | Плацебо |
| Популяция для анализа (N) | 1306 | 655 |
| Масса тела | ||
| Исходные данные (кг) | 105.4 | 105.2 |
| Изменение (%) от исходных данных1,2 | -14.9 | -2.4 |
| Отличие (%) от плацебо1 [95% ДИ] | -12.4 [-13.4; -11.5]* | - |
| Изменение (кг) от исходного уровня | -15.3 | -2.6 |
| Отличие (кг) от плацебо1 [95% ДИ] | -12.7 [-13.7; -11.7] | - |
| Пациенты (%), достигшие потери массы тела ≥ 5%3 | 83.5* | 31.1 |
| Пациенты (%), достигшие потери массы тела ≥ 10%3 | 66.1* | 12.0 |
| Пациенты (%), достигшие потери массы тела ≥ 15%3 | 47.9* | 4.8 |
| Окружность талии (см) | ||
| Исходные данные | 114.6 | 114.8 |
| Изменение от исходных данных1 | -13.5 | -4.1 |
| Отличие от плацебо1 [95% ДИ] | -9.4 [-10.3; -8.5]* | - |
| Систолическое АД (мм рт. ст.) | ||
| Исходные данные | 126 | 127 |
| Изменение от исходных данных1 | -6.2 | -1.1 |
| Отличие от плацебо1 [95% ДИ] | 5.1 [-6.3; -3.9]* | - |
*p < 0.0001 (нескорректированный 2-сторонний) для доказательства превосходства.
1 Оценено с помощью модели ANCOVA с использованием MI (multiple imputation) на основе всех данных, независимо от прекращения исследуемой терапии или начала приема других препаратов для лечения ожирения или бариатрической хирургии.
2 В ходе исследования исследуемый препарат полностью прекратили 17.1% и 22.4% пациентов, рандомизированных в группы приема семаглутида в дозе 2.4 мг и плацебо, соответственно. При условии, что все рандомизированные пациенты продолжали лечение и не получали дополнительной терапии для лечения ожирения, расчетные изменения массы тела от момента рандомизации до 68-й недели на основе анализа MMRMs, включающей все наблюдения до первого прекращения лечения, составили -16.9% и -2.4% для семаглутида в дозе 2.4 мг и плацебо соответственно.
3 Оценено по модели бинарной регрессии на основе того же метода восстановления данных, что и в первичном анализе.
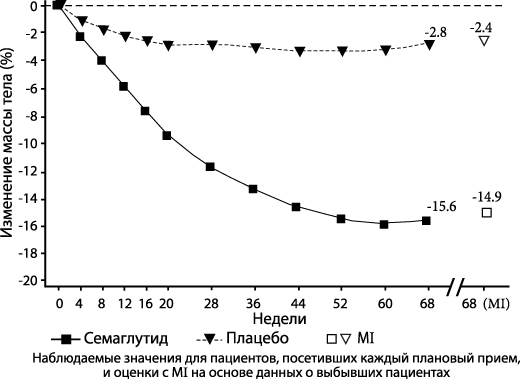
Рис. 1 STEP 1: среднее изменение массы тела (%) с исходного уровня до 68-й недели
После проведения исследования продолжительностью 68 недель было проведено дополнительное исследование без лечения продолжительностью 52 недели, в которое были включены 327 пациентов, завершивших основной период исследования на поддерживающей дозе семаглутида или плацебо. В отсутствие лечения с 68 по 120 неделю средняя масса тела увеличилась в обеих группах лечения. При этом у пациентов, получавших семаглутид в течение основного периода исследования, масса тела оставалась на 5.6% ниже исходного уровня по сравнению с 0.1% в группе плацебо.
STEP 2: Контроль массы тела у пациентов с СД2
В двойном слепом исследовании продолжительностью 68 недель 1210 пациентов с избыточной массой тела или ожирением (ИМТ ≥ 27 кг/м2) с СД2 были рандомизированы в группы с применением семаглутида в дозе 2.4 мг 1 раз в неделю, семаглутида в дозе 1 мг один раз в неделю или плацебо. Включенные в исследование пациенты имели недостаточно контролируемый сахарный диабет (HbA1c 7-10%) и получали лечение либо только в виде диеты и физических упражнений, либо 1-3 пероральных гипогликемических препаратов. Все пациенты соблюдали диету с пониженным содержанием калорий и сохраняли повышенную физическую активность на протяжении всего исследования.
Применение семаглутида в течение 68 недель привело к клинически значимому снижению массы тела и уровня HbA1c по сравнению с плацебо (см. Таблицу 2 и Рисунок 2).
Таблица 2. STEP 2: результаты на 68-й неделе
| Параметры | Семаглутид | Плацебо |
| Популяция для анализа (N) | 404 | 403 |
| Масса тела | ||
| Исходные данные (кг) | 99.9 | 100.5 |
| Изменение (%) от исходных данных1,2 | -9.6 | -3.4 |
| Отличие (%) от плацебо1 [95% ДИ] | -6.2 [-7.3;-5.2]* | - |
| Изменение (кг) от исходного уровня | -9.7 | -3.5 |
| Отличие (кг) от плацебо1 [95% ДИ] | -6.1 [-7.2;-5.0] | - |
| Пациенты (%), достигшие потери массы тела ≥ 5%3 | 67,4* | 30,2 |
| Пациенты (%), достигшие потери массы тела ≥ 10%3 | 44,5* | 10,2 |
| Пациенты (%), достигшие потери массы тела ≥ 15%3 | 25,0* | 4,3 |
| Окружность талии (см) | ||
| Исходные данные | 114.5 | 115.5 |
| Изменение от исходных данных1 | -9.4 | -4.5 |
| Отличие от плацебо1 [95% ДИ] | -4.9 [-6.0; -3.8]* | - |
| Систолическое АД (мм рт. ст.) | ||
| Исходные данные | 130 | 130 |
| Изменение от исходных данных1 | -3,9 | -0,5 |
| Отличие от плацебо1 [95% ДИ] | -3,4 [-5,6; -1,3]** | - |
| HbA1c (ммоль/моль (%)) | ||
| Исходные данные | 65.3 (8.1) | 65.3 (8.1) |
| Изменение от исходных данных1 | -17.5 (-1.6) | -4.1 (-0.4) |
| Отличие от плацебо1 [95% ДИ] | -13,5 [-15,5; -11,4] (-1,2 [-1,4; -1,1])* | - - |
*p < 0,0001 (нескорректированный 2-сторонний) для превосходства.
**p < 0,05 (нескорректированный 2-сторонний) для превосходства.
1 Оценено с помощью модели ANCOVA с использованием MI с учетом всех данных, независимо от прекращения исследуемой терапии или начала приема других препаратов для лечения ожирения или бариатрической хирургии.
2 В ходе исследования рандомизированное лечение полностью прекратили 11.6% и 13.9% пациентов, рандомизированных в группы с применением семаглутида в дозе 2.4 мг и плацебо, соответственно. При условии, что все рандомизированные пациенты продолжали лечение и не получали дополнительной терапии для лечения ожирения, рассчитанные изменения массы тела от момента рандомизации до 68 недели с применением MMRMs, включающей все наблюдения до первого прекращения лечения, составили -10.6% и -3.1% для семаглутида в дозе 2.4 мг и плацебо соответственно.
3 Оценено по модели бинарной регрессии на основе того же метода восстановления данных, что и в первичном анализе.
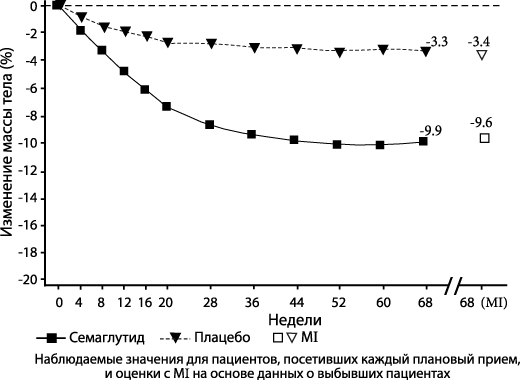
Рис. 2 STEP 2: среднее изменение массы тела (%) с исходного уровня по 68 неделю
STEP 3: контроль массы тела с помощью бихевиоральной психотерапии
В двойном слепом исследовании продолжительностью 68 недель 611 пациентов с ожирением (ИМТ ≥ 30 кг/м2) или с избыточной массой тела (ИМТ от ≥ 27 кг/м2 до < 30 кг/м2) и наличием хотя бы одного связанного с избыточной массой тела сопутствующего заболевания были рандомизированы в группы с применением семаглутида или плацебо. В ходе исследования все пациенты проходили курс бихевиоральной психотерапии, включающую очень строгую диету, повышенную физическую активность и коррекцию поведения. Применение семаглутида и бихевиоральной психотерапии в течение 68 недель показали превосходство и привели к клинически значимому снижению массы тела в группе терапии семаглутидом по сравнению с приемом плацебо (см. Таблицу 3).
Таблица 3. STEP 3: результаты на 68-й неделе
| Параметры | Семаглутид | Плацебо |
| Популяция для анализа (N) | 407 | 204 |
| Масса тела | ||
| Исходные данные (кг) | 106.9 | 103.7 |
| Изменение (%) от исходных данных1,2 | -16.0 | -5.7 |
| Отличие (%) от плацебо1 [95% ДИ] | -10.3 [-12.0;-8.6]* | - |
| Изменение (кг) от исходного уровня | -16.8 | -6.2 |
| Отличие (кг) от плацебо1 [95% ДИ] | -10.6 [-12.5;-8.8] | - |
| Пациенты (%), достигшие потери массы тела ≥ 5%3 | 84.8* | 47.8 |
| Пациенты (%), достигшие потери массы тела ≥ 10%3 | 73.0* | 27.1 |
| Пациенты (%), достигшие потери массы тела ≥ 15%3 | 53.5* | 13.2 |
| Окружность талии (см) | ||
| Исходные данные | 113.6 | 111.8 |
| Изменение от исходных данных1 | -14.6 | -6.3 |
| Отличие от плацебо1 [95% ДИ] | -8.3 [-10.1; -6.6]* | - |
| Систолическое АД (мм рт. ст.) | ||
| Исходные данные | 124 | 124 |
| Изменение от исходных данных1 | -5.6 | -1.6 |
| Отличие от плацебо1 [95% ДИ] | -3.9 [-6.4; -1.5]* | - |
*p < 0.005 (нескорректированный 2-сторонний) для доказательства превосходства.
1 Оценено с помощью модели ANCOVA с использованием метода MI с учетом всех данных, независимо от прекращения исследуемой терапии или начала приема других препаратов для лечения ожирения или бариатрической хирургии.
2 В ходе исследования исследуемую терапию полностью прекратили 16.7% и 18.6% пациентов, рандомизированных в группы семаглутида в дозе 2.4 мг и плацебо, соответственно. При условии, что все рандомизированные пациенты продолжали лечение и не получали дополнительной терапии для лечения ожирения, рассчитанные изменения массы тела от момента рандомизации до 68 недели методом MMRMs, включающей все наблюдения до первого прекращения лечения, составили -17.6% и -5.0% для семаглутида в дозе 2.4 мг и плацебо соответственно.
3 Оценено по модели бинарной регрессии на основе того же метода восстановления данных, что и в первичном
анализе.
STEP 4: контроль массы тела на поддерживающей терапии
В двойное слепое исследование продолжительностью 68 недель было включено 902 пациента с ожирением (ИМТ ≥ 30 кг/м2) или с избыточной массой тела (ИМТ от ≥ 27 кг/м2 до 30 кг/м2) и наличием хотя бы одного связанного с избыточной массой тела сопутствующего заболевания. Все пациенты соблюдали диету с пониженным содержанием калорий и сохраняли повышенную физическую активность на протяжении всего исследования. Все пациенты получали семаглутид с 0-й по 20-ю неделю (вводная фаза). На 20-й неделе (исходный уровень) пациенты, достигшие поддерживающей дозы 2.4 мг, были рандомизированы в группы продолжения лечения или перехода на плацебо. На 0-й неделе (начало вводной фазы) средняя масса тела пациентов составляла 107.2 кг, а средний ИМТ – 38.4 кг/м2.
Пациенты, достигшие поддерживающей дозы 2.4 мг на 20-й неделе (исходный уровень) и продолжившие применение семаглутида в течение 48 недель (20–68-я недели), продолжали снижать массу тела, было показано превосходство и клинически значимое снижение массы тела по сравнению с получающими плацебо пациентами (см. Таблицу 4 и Рисунок 3). Масса тела стабильно увеличивалась с 20-й по 68-ю неделю у перешедших на плацебо на 20-й неделе (исходный уровень) пациентов. При этом средняя масса тела на 68-й неделе была ниже, чем в начале вводной фазы (0-я неделя) (см. Рисунок 3). У получавших семаглутид пациентов с 0-й недели (вводная фаза) по 68-ю неделю (завершение лечения) среднее изменение массы тела составило – 17.4%, при этом снижение массы тела на ≥ 5% было достигнуто 87.8%, на ≥ 10%-78.0%, на ≥15%-62.2% и на ≥ 20%-38.6% пациентов.
Таблица 4. STEP 4: результаты с 20-й по 68-ю недели
| Параметры | Семаглутид | Плацебо |
| Популяция для анализа (N) | 535 | 268 |
| Масса тела | ||
| Исходные данные1 (кг) | 96.5 | 95.4 |
| Изменение (%) от исходных данных1,2,3 | 7.9 | 6.9 |
| Отличие (%) от плацебо2 [95% ДИ] | -14.8 [-16.0; -13.5]* | - |
| Изменение (кг) от исходного уровня | -7.1 | 6.1 |
| Отличие (кг) от плацебо2 [95% ДИ] | -13.2 [-14.3; -12.0] | - |
| Окружность талии (см) | ||
| Исходные данные | 105.5 | 104.7 |
| Изменение от исходных данных1 | -6.4 | 3.3 |
| Отличие от плацебо2 [95% ДИ] | -9.7 [-10.9; -8.5]* | - |
| Систолическое АД (мм рт. ст.) | ||
| Исходные данные1 | 121 | 121 |
| Изменение от исходных данных1,2 | 0.5 | 4.4 |
| Отличие от плацебо2 [95% ДИ] | -3.9 [-5.8; -2.0]* | - |
* p < 0.0001 (нескорректированный 2-сторонний) для доказательства превосходства.
1 Исходные данные = неделя 20
2 Оценено с помощью модели ANCOVA с использованием метода MI с учетом всех данных, независимо от прекращения исследуемой терапии или начала приема других препаратов для лечения ожирения или бариатрической хирургии.
3 В ходе исследования исследуемую терапию полностью прекратили 5.8% и 11.6% пациентов, рандомизированных в группы семаглутида в дозе 2.4 мг и плацебо, соответственно. При условии, что все рандомизированные пациенты продолжали лечение и не получали дополнительной терапии для лечения ожирения, рассчитанные изменения массы тела от момента рандомизации до 68-й недели на основе смешанной модели повторных измерений, включающей все наблюдения до первого прекращения лечения, составили -8.1% и 6.5% для семаглутида в дозе 2.4 мг и плацебо соответственно.
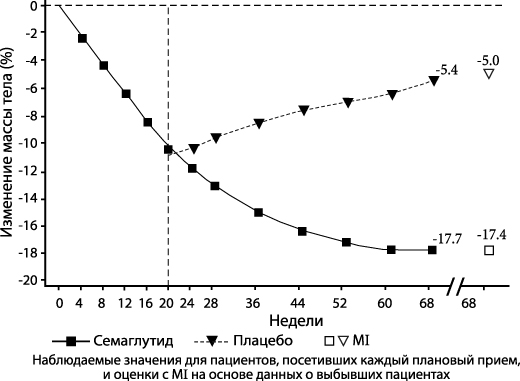
Рис. 3. STEP 4: среднее изменение массы тела (%) с 0-й по 68-ю неделю
STEP 5: 2-годичное исследование
В двойном слепом исследовании продолжительностью 104 недели в группы семаглутида или плацебо было рандомизировано 304 пациента с ожирением (ИМТ ≥ 30 кг/м2) или с избыточной массой тела (ИМТ от ≥ 27 кг/м2 до < 30 кг/м2) и наличием хотя бы одного связанного с избыточной массой тела сопутствующего заболевания. Все пациенты соблюдали диету с пониженным содержанием калорий и сохраняли повышенную физическую активность на протяжении всего исследования. На исходном уровне средний ИМТ пациентов составлял 38.5 кг/м2, средняя масса тела – 106.0 кг.
Применение семаглутида в течение 104 недель показало превосходство терапии и клинически значимое снижение массы тела по сравнению с применением плацебо. Средняя масса тела снижалась с исходного уровня до 68-й недели в группе семаглутида, после чего наступало плато. При применении плацебо средняя масса тела снижалась медленнее, и плато было достигнуто примерно через 20 недель лечения (см. Таблицу 5 и Рисунок 4). У принимавших семаглутид пациентов среднее изменение массы тела составило – 15.2%, при этом снижение массы тела на ≥ 5% было достигнуто 74.7%, на ≥ 10%-59.2%, на ≥15%-49.7% пациентов.
Среди пациентов, у которых на начальном этапе исследования наблюдался предиабет, у 80% и 37% был показан нормальный гликемический статус к концу применения семаглутида и плацебо соответственно.
Таблица 5. STEP 5: результаты на 104-й неделе
| Параметры | Семаглутид | Плацебо |
| Популяция для анализа (N) | 152 | 152 |
| Масса тела | ||
| Исходные данные (кг) | 105.6 | 106.5 |
| Изменение (%) от исходных данных1,2 | -15.2 | -2.6 |
| Отличие (%) от плацебо1 [95% ДИ] | -12.6 [-15.3; -9.8]* | - |
| Изменение (кг) от исходного уровня | -16.1 | -3.2 |
| Отличие (кг) от плацебо1 [95% ДИ] | -12.9 [-16.1; -9.8] | - |
| Пациенты (%), достигшие потери массы тела ≥ 5%3 | 74.7* | 37.3 |
| Пациенты (%), достигшие потери массы тела ≥ 10%3 | 59.2* | 16.8 |
| Пациенты (%), достигшие потери массы тела ≥ 15%3 | 49.7* | 9.2 |
| Окружность талии (см) | ||
| Исходные данные | 115.8 | 115.7 |
| Изменение от исходных данных1 | -14.4 | 5.2 |
| Отличие от плацебо1 [95% ДИ] | -9.2 [-12.2; -6.2]* | - |
| Систолическое АД (мм рт. ст.) | ||
| Исходные данные | 125 | 126 |
| Изменение от исходных данных1 | -5.7 | -1.6 |
| Отличие от плацебо1 [95% ДИ] | -4.2 [-7.3; -1,0]* | - |
* p < 0.0001 (нескорректированный 2-сторонний) для доказательства превосходства.
1 Оценено с помощью модели ANCOVA с использованием MI с учетом всех данных, независимо от прекращения исследуемой терапии или начала приема других препаратов для лечения ожирения или бариатрической хирургии.
2 В ходе исследования исследуемую терапию полностью прекратили 13.2% и 27.0% пациентов, рандомизированных в группы семаглутида и плацебо, соответственно. При условии, что все рандомизированные пациенты продолжали лечение и не получали дополнительной терапии лечения ожирения, рассчитанные изменения массы тела от момента рандомизации до 68-й недели на основе MMRMs, включающей все наблюдения до первого прекращения лечения, составили -16.7% и -0.6% для семаглутида и плацебо соответственно.
3 Оценено по модели бинарной регрессии на основе того же метода восстановления данных, что и в первичном анализе.
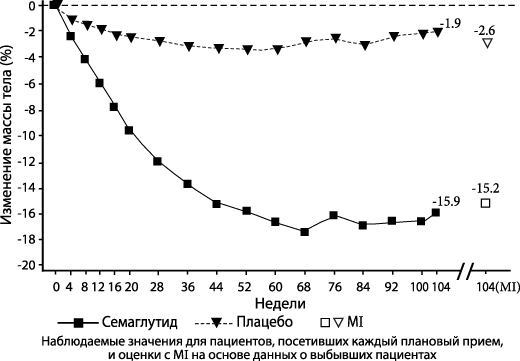
Рисунок 4. STEP 5: среднее изменение массы тела (%) с 0-й по 104-ю неделю
STEP 6: семаглутид в сравнении с лираглутидом
В рандомизированном открытом парном плацебо-контролируемом исследовании продолжительностью 68 недель 338 пациентов с ожирением (ИМТ ≥ 30 кг/м2) или с избыточной массой тела (ИМТ от ≥ 27 до < 30 кг/м2) и наличием хотя бы одного связанного с избыточной массой тела сопутствующего заболевания были рандомизированы в группы семаглутида 1 раз в неделю, лираглутида в дозе 3 мг 1 раз/сут или плацебо.
Исследование с применением семаглутида 1 раз в неделю и лираглутида в дозе 3 мг было открытым, но в каждой группе лечения активным препаратом проводилось двойное слепое сравнение с плацебо, назначенным с той же частотой применения. Все пациенты соблюдали диету с пониженным содержанием калорий и сохраняли повышенную физическую активность на протяжении всего исследования. На исходном уровне средний ИМТ пациентов составлял 37.5 кг/м2, средняя масса тела – 104.5 кг.
Применение семаглутида 1 раз в неделю в течение 68 недель показало превосходство терапии и клинически значимое снижение массы тела по сравнению с применением лираглутида. Средняя масса тела снижалась с исходного уровня до 68-й недели с применением семаглутида. В группе лираглутида средняя масса тела снижалась медленнее (см. Таблицу 6). 37.4% получавших семаглутид пациентов потеряли ≥ 20% массы тела по сравнению с 7.0% пациентов, получавших лираглутид. В Таблице 6 представлены результаты подтверждающих конечных точек ≥ 10%, ≥15% и ≥ 20% потери массы тела.
Таблица 6. STEP 6: результаты исследования по сравнению семаглутида с лираглутидом продолжительностью 68 недель
| Параметры | Семаглутид | Плацебо |
| Популяция для анализа (N) | 126 | 127 |
| Масса тела | ||
| Исходные данные (кг) | 102.5 | 103.7 |
| Изменение (%) от исходных данных1,2 | -15.8 | -6.4 |
| Отличие (%) от лираглутида1 [95% ДИ] | -9.4 [-12.0;-6.8]* | - |
| Изменение (кг) от исходного уровня | -15.3 | -6.8 |
| Отличие (кг) от лираглутида1 [95% ДИ] | -8.5 [-11.2;-5.7] | - |
| Пациенты (%), достигшие потери массы тела ≥ 10%3 | 69.4* | 27.2 |
| Пациенты (%), достигшие потери массы тела ≥ 15%3 | 54.0* | 13.4 |
| Пациенты (%), достигшие потери массы тела ≥ 20%3 | 37.4* | 7.0 |
* p < 0,005 (нескорректированный 2-сторонний) для доказательства превосходства.
1 Оценено с помощью модели ANCOVA с использованием MI с учетом всех данных, независимо от прекращения исследуемой терапии или начала приема других препаратов для лечения ожирения или бариатрической хирургии.
2 В ходе исследования исследуемую терапию полностью прекратили 13.5% и 27.6% пациентов, рандомизированных в группы семаглутида и лираглутида, соответственно.
При условии, что все рандомизированные пациенты продолжали лечение и не получали дополнительной терапии для лечения ожирения, рассчитанные изменения массы тела от момента рандомизации до 68-й недели на основе анализа MMRMs, включающей все наблюдения до первого прекращения лечения, составили – 16.7% и -6.7% для семаглутида и лираглутида соответственно.
3 Оценено по модели бинарной регрессии на основе того же метода восстановления данных, что и в первичном анализе.
Влияние на состав тела
В дополнительном исследовании STEP 1 (N = 140) состав тела оценивался с помощью двухэнергетической рентгеновской абсорбциометрии (DEXA). Результаты оценки DEXA показали, что лечение семаглутидом сопровождалось большим снижением жировой массы, чем мышечной, что привело к улучшению состава тела по сравнению с плацебо через 68 недель. Кроме того, это снижение общей жировой массы сопровождалось уменьшением количества висцерального жира. Данные результаты свидетельствуют о том, что снижение общей массы тела было обусловлено уменьшением жировой ткани, включая висцеральный жир.
Улучшение физических функций
Семаглутид продемонстрировал небольшое улучшение показателей физических функций. Физические функции оценивались с использованием как общего опросника качества жизни, связанного со здоровьем "Краткая форма-36v2 Health Survey, (SF-36)", так и опросника для клинических испытаний, связанного с ожирением "Влияние массы тела на качество жизни" (IWQOL-Lite-CT).
Оценка состояния сердечно-сосудистой системы
В исследовании SUSTAIN 6 с участием 3297 пациентов с недостаточным контролем СД2 и высоким риском сердечно-сосудистых осложнений были рандомизированы в группу с применением семаглутида в дозе 0.5 мг или 1 мг 1 раз в неделю или плацебо в дополнение к стандартной терапии. Продолжительность лечения составила 104 недели. Средний возраст составил 65 лет, средний ИМТ – 33 кг/м2.
Первичной конечной точкой было время от рандомизации до первого серьезного сердечно-сосудистого события (СССС), такого как смерть по причине сердечно-сосудистой патологии, инфаркт миокарда без смертельного исхода или инсульт без смертельного исхода. Общее количество СССС составило 254, в т.ч. 108 (6.6%) с применением семаглутида и 146 (8.9%) с плацебо.
Безопасность лечения семаглутидом в дозе 0.5 или 1 мг для сердечно-сосудистой системы была подтверждена: коэффициент риска (КР) для семаглутида в сравнении с плацебо составил 0.74, [0.58, 0.95] [95% ДИ], что обусловлено снижением частоты возникновения инфаркта миокарда без смертельного исхода или инсульта без смертельного исхода при отсутствии разницы в смерти от сердечно-сосудистых осложнений (см. Рисунок 5).
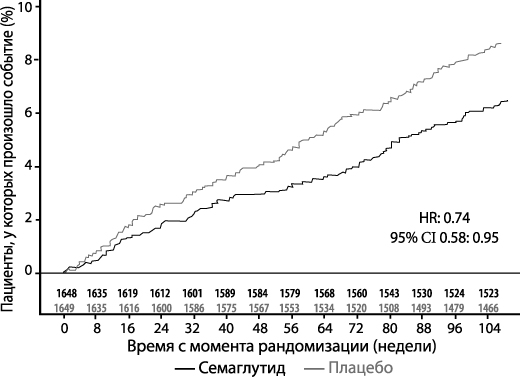
Рисунок 5. График Каплана-Майера по времени до первого наступления комбинированного исхода: смерть от сердечно-сосудистых осложнений, инфаркт миокарда без смертельного исхода или инсульт без смертельного исхода (КИ SUSTAIN 6)
Данные доклинической безопасности
Проведенные доклинические исследования по оценке токсичности при многократном введении, фармакологической безопасности и генотоксичности не выявили рисков для человека.
Наблюдаемые только у грызунов доброкачественные новообразования C-клеток щитовидной железы являются характерным эффектом для класса агонистов рецептора ГПП-1.
В исследовании канцерогенности при многократном, длительном введении (2 года) семаглутида крысам и мышам в дозах, значительно превышающих терапевтические, наблюдалось возникновение C-клеточных доброкачественных новообразований щитовидной железы.
Важно отметить, что других новообразований, связанных с применением семаглутида, выявлено не было.
Возникновение доброкачественных новообразований щитовидной железы у грызунов обусловлено специфическим негенотоксическим ГПП-1-рецептор-опосредованным механизмом, к которому частично чувствительны грызуны. Считается, что в отношении людей данный риск является низким, однако не может быть полностью исключен.
В исследованиях репродуктивной токсичности при оценке фертильности у крыс влияния семаглутида на фертильность у самцов или способность к спариванию выявлено не было.
В дозах, сопровождавшихся снижением массы тела, наблюдалось увеличение эстрального цикла и незначительное снижение числа желтых тел (овуляций).
В исследованиях эмбриональной токсичности было выявлено эмбриотоксическое действие при экспозиции, которая была ниже терапевтически значимого уровня. Семаглутид оказывал влияние на развитие эмбриона и плода.
Семаглутид вызывал заметное снижение массы тела самок и уменьшение показателей выживаемости и роста эмбрионов. У плодов наблюдались серьезные скелетные и висцеральные пороки развития, включая изменения в длинных костях, ребрах, позвоночнике, костях хвоста, кровеносных сосудах и желудочках головного мозга.
Выявленная эмбриотоксичность вызвана нарушением поступления питательных веществ к эмбриону через желточный мешок крысы, опосредованным рецептором ГПП-1. Из-за видовых различий в анатомии и функции желточного мешка, а также из-за недостаточной экспрессии рецепторов ГПП-1 в желточном мешке у нечеловеческих приматов, этот механизм считается маловероятным для человека. Однако возможность непосредственного влияния семаглутида на плод исключить нельзя.
В исследованиях эмбриотоксического действия семаглутида в терапевтических дозах на развитие плодов кроликов и яванских макак наблюдалось увеличение частоты случаев потери беременности и некоторое увеличение частоты аномалий плода с заметной потерей массы тела у самок, достигающей 16%. Неизвестно, связаны ли данные эффекты с уменьшением потребления самками пищи вследствие непосредственного воздействия ГПП-1.
В исследованиях по изучению эмбриотоксического действия семаглутида у яванских макак оценивали развитие потомства в постнатальном периоде. Следует отметить, что у яванских макак, получавших семаглутид, масса тела потомства при рождении была несколько меньше, чем в контроле, однако их масса тела восстанавливалась в течение периода грудного вскармливания.
У крыс ювенильного возраста семаглутид вызывал задержку полового созревания, как у самцов, так и у самок, однако это не оказало влияния на фертильность и репродуктивную функцию обоих полов, а также на способность самок сохранять беременность.
Фармакокинетика
В отличие от нативного ГПП-1, семаглутид имеет длительный T1/2 около 1 недели, что позволяет применять его п/к 1 раз в неделю.
Основным механизмом длительного действия семаглутида является связывание с альбумином, что приводит к снижению выведения его почками и защищает от метаболического распада.
Кроме того, семаглутид обладает гидролитической стабильностью ввиду его физико-химических свойств, что защищает его от гидролиза ферментом дипептидилпептидазой-4 (ДПП-4).
Всасывание
После п/к введения поддерживающей терапевтической дозы семаглутида его средняя Css составляла приблизительно 75 нмоль/л у пациентов с избыточной массой тела (ИМТ от > 27 кг/м2 до < 30 кг/м2) или ожирением (ИМТ > 30 кг/м2) на основании данных исследований фазы 3а, где у 90% пациентов средняя концентрация составляла от 51 нмоль/л до 110 нмоль/л. При применении доз от 0.25 мг до 2.4 мг 1 раз в неделю экспозиция семаглутида увеличивалась пропорционально дозе. Экспозиция препарата была стабильной, по оценкам, вплоть до 68-й недели. Влияние места введения на экспозицию семаглутида не выявлено, так при п/к введении семаглутида в переднюю брюшную стенку, бедро или плечо достигались схожие фармакокинетические параметры.
Абсолютная биодоступность семаглутида составила 89%.
Распределение
После п/к введения у пациентов с избыточной массой тела или ожирением средний Vd семаглутида составил приблизительно 12.4 л. Семаглутид в значительной степени связывается с альбумином плазмы (> 99%).
Метаболизм
Семаглутид интенсивно метаболизируется путем протеолитического расщепления пептидной цепи и последовательного бета-окисления жирной кислоты боковой цепи с последующей элиминацией из организма. Большая часть семаглутида метаболизируется за счет нейтральной эндопептидазы (НЭП).
Выведение
Основные пути выведения производных семаглутида почечная и энтерогепатическая элиминация. Приблизительно 3% семаглутида от введенной дозы выводилось с мочой в неизмененном виде.
У пациентов с избыточной массой тела (ИМТ от ≥ 27 кг/м2 до < 30 кг/м2) или ожирением (ИМТ ≥ 30 кг/м2) клиренс семаглутида составлял примерно 0.05 л/ч. При T1/2 продолжительностью около 1 недели следы семаглутида присутствуют в кровотоке в течение около 7 недель после введения последней дозы 2.4 мг.
Особые группы пациентов
Почечная недостаточность
Почечная недостаточность не влияет на фармакокинетику семаглутида клинически значимым образом.
По результатам КИ, в которых семаглутид применялся в однократной дозе 0.5 мг у пациентов с различной степенью почечной недостаточности (легкая, умеренная, тяжелая или пациенты на диализе), не было выявлено клинически значимого влияния семаглутида на фармакокинетику у пациентов с почечной недостаточностью по сравнению с пациентами с нормальной функцией почек.
Данные результаты так же были подтверждены в КИ фазы 3а у пациентов с избыточной массой тела (ИМТ? 27 кг/м2 до < 30 кг/м2) или ожирением (ИМТ? 30 кг/м2) и легкой или умеренной почечной недостаточностью.
Лица пожилого возраста
В КИ фазы 3, включавших пациентов в возрасте от 18 до 86 лет, было показано отсутствие влияния возраста на фармакокинетику семаглутида.
Пол, раса и этническая принадлежность
Данные, полученные в ходе КИ фазы 3а, показали отсутствие влияния на фармакокинетику семаглутида пола, расы (европеоидная, негроидная или монголоидная), а также этнической принадлежности (испанского или латиноамериканского происхождения, не испанского или не латиноамериканского происхождения).
Масса тела
КИ показали значимое влияние массы тела на экспозицию семаглутида. Так, более высокая масса тела приводит к более низкой экспозиции; разница в массе тела в 20% между пациентами приводит к разнице в экспозиции примерно в 18%. Еженедельная доза семаглутида 2.4 мг обеспечивает достаточную системную экспозицию в диапазоне массы тела 54.4-245.6 кг, которая оценивалась с учетом ответной реакции на экспозицию в КИ.
Печеночная недостаточность
Печеночная недостаточность не влияла на экспозицию семаглутида. Влияние печеночной недостаточности на фармакокинетические параметры семаглутида оценивалось в КИ при однократном введении семаглутида в дозе, равной 0,5 мг у пациентов с различной степенью печеночной недостаточности (легкой, средней, тяжелой) в сравнении с пациентами с нормальной функцией печени.
Предиабет и сахарный диабет
В КИ фазы IIIа наличие у пациентов предиабета или сахарного диабета не оказывало клинически значимого влияния на экспозицию семаглутида.
Иммуногенность
При лечении семаглутидом образование антител к семаглутиду наблюдалось редко (см. "Побочное действие"), и данная реакция не влияла на фармакокинетику семаглутида.
Дети
Безопасность и эффективность применения семаглутида у детей и подростков младше 18 лет не изучались.
Показания препарата Инсудайв® Слим
Препарат Инсудайв® Слим показан в качестве дополнения к низкокалорийной диете и повышенной физической активности для контроля массы тела, включая снижение и поддержание массы тела, у взрослых от 18 лет с исходным индексом массы тела (ИМТ):
- ≥ 30 кг/м2 или
- ≥ 27 кг/м2 до < 30 кг/м2 (избыточная масса тела) при наличии хотя бы одного связанного с избыточной массой тела сопутствующего заболевания, такого как предиабет или сахарный диабет 2 типа (СД2), артериальная гипертензия, дислипидемия, синдром обструктивного апноэ во сне или сердечно-сосудистые заболевания.
Режим дозирования
Для подкожного введения.
Препарат Инсудайв® Слим нельзя вводить в/в или в/м.
Препарат Инсудайв® Слим вводят один раз в неделю в любое время суток, независимо от приема пищи.
Препарат Инсудайв® Слим следует вводить п/к в область живота, бедра или верхней части плеча. Место инъекции можно менять.
При необходимости день еженедельного введения можно менять при условии, что интервал между двумя инъекциями составляет не менее 3 дней (> 72 часов).
После выбора нового дня введения следует продолжить введение препарата 1 раз в неделю.
Рекомендуемая начальная доза составляет 0.25 мг 1 раз в неделю.
Максимальная поддерживающая (терапевтическая) доза семаглутида составляет 2.4 мг 1 раз в неделю.
Чтобы снизить вероятность возникновения желудочно-кишечных нежелательных реакций, дозу следует увеличивать в течение 16 недель, начиная с дозы 0.25 мг до поддерживающей терапевтической дозы 2.4 мг 1 раз в неделю по следующей схеме увеличения дозы (см. Таблицу 7). В случае возникновения серьезных желудочно-кишечных симптомов следует рассмотреть возможность отсрочки увеличения дозы или снижения до предыдущей дозы до тех пор, пока симптомы не исчезнут. Не рекомендуется введение более 2.4 мг в неделю.
Таблица 7. Схема увеличения дозы
| Неделя терапии | Доза в неделю/одна инъекция |
| Неделя 1-4 | 0.25 мг |
| Неделя 5-8 | 0.5 мг |
| Неделя 9-12 | 1 мг |
| Неделя 13-16 | 1.7 мг |
| 17 неделя и далее / Поддерживающая (терапевтическая) доза | 2.4 мг |
Пациенты с СД2
При назначении семаглутида пациентам с СД2 следует рассмотреть вариант возможности снижения дозы инсулина или препаратов, повышающих секрецию инсулина (например, производных сульфонилмочевины), чтобы снизить риск развития гипогликемии (см. раздел "Особые указания").
Пропущенная доза
В случае пропуска дозы препарат Инсудайв® Слим следует ввести как можно быстрее в течение 5 дней с момента запланированного введения дозы. Если продолжительность пропуска составляет более 5 дней, пропущенную дозу вводить не нужно. Следующую дозу препарата Инсудайв® Слим следует ввести, как обычно, в запланированный день. В каждом случае пациенты могут возобновить их обычный однократный еженедельный график введения. Если пропущено большее количество доз, следует рассмотреть возможность снижения 4 дозы до начальной дозы для повторного начала лечения.
Особые группы пациентов
Пациенты пожилого возраста (≥ 65). Коррекция дозы не требуется. Опыт применения препарата у пациентов в возрасте ≥75 лет ограничен. Нельзя исключать повышенную чувствительность к семаглутиду у некоторых людей пожилого возраста.
Пациенты с нарушением функции почек. Пациентам с легкой или умеренной степенью почечной недостаточности коррекция дозы не требуется. Опыт применения семаглутида у пациентов с тяжелой почечной недостаточностью ограничен. Семаглутид не рекомендуется применять пациентам с тяжелой почечной недостаточностью (расчетная скорость клубочковой фильтрации [рСКФ] < 30 мл/мин/1.73 м2), включая пациентов с терминальной стадией почечной недостаточности.
Пациенты с нарушением функции печени. Пациентам с легкой или умеренной степенью печеночной недостаточности коррекция дозы не требуется. Опыт применения семаглутида у пациентов с тяжелой печеночной недостаточностью ограничен. Семаглутид не рекомендуется применять пациентам с тяжелой печеночной недостаточностью и следует с осторожностью назначать пациентам с легкой или умеренной печеночной недостаточностью.
Дети. Безопасность и эффективность семаглутида у детей и подростков в возрасте до 18 лет не установлены. Данные отсутствуют.
Инструкция по применению предварительно заполненной шприц-ручки с препаратом Инсудайв® Слим
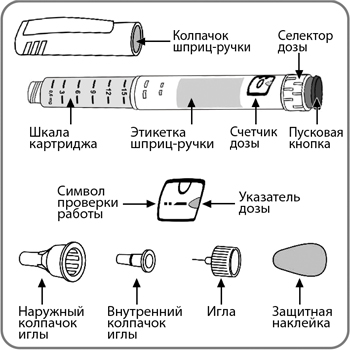
Начните с проверки шприц-ручки, чтобы убедиться, что в ней содержится препарат Инсудайв® Слим 0.25 мг/доза, 0.5 мг/доза, 1 мг/доза. 1,7 мг/доза или 2.4 мг/доза, затем посмотрите на представленные ниже иллюстрации, чтобы ознакомиться с различными частями шприц-ручки и иглы.
Шприц-ручка разработана для использования с одноразовыми иглами длиной до 8 мм. Иглы включены в упаковку.
Предварительно заполненная шприц-ручка с препаратом Инсудайв® Слим и игла (пример)
1. Подготовка шприц-ручки с новой иглой к использованию
- Проверьте название и цветовой код на этикетке шприц-ручки, чтобы убедиться, что в ней содержится препарат Инсудайв® Слим. Это особенно важно, если Вы применяете®более одного инъекционного препарата. Применение неправильного препарата может®нанести серьезный вред Вашему здоровью.
- Снимите колпачок со шприц-ручки (рис. 1).
Рис. 1
- Убедитесь, что раствор в шприц-ручке прозрачный, бесцветный или со слегка коричневатым оттенком (рис. 2).
Посмотрите в окошко шприц-ручки. Если раствор мутный, не бесцветный или не со слегка коричневатым оттенком, то не используйте шприц-ручку.
Рис. 2.
- Возьмите новую иглу.
Проверьте защитную наклейку и наружный колпачок иглы на наличие повреждений, которые могут влиять на стерильность иглы. Если Вы заметили какие-либо повреждения, не используйте данную иглу.
- Удалите защитную наклейку (рис. 3).
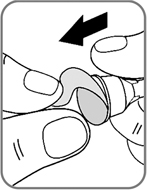
Рис. 3
- Наденьте иглу на шприц-ручку и поверните ее, чтобы игла плотно держалась на шприц-ручке (рис. 4).
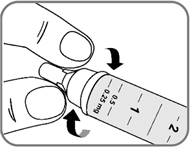
Рис 4
- Снимите наружный колпачок иглы, но не выбрасывайте его (рис. 5). Он понадобится Вам после завершения инъекции, чтобы безопасно снять иглу со шприц-ручки.
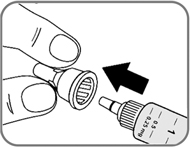
Рис. 5
- Снимите и выбросьте внутренний колпачок иглы (рис. 6). Если Вы попытаетесь надеть внутренний колпачок обратно на иглу, Вы можете случайно уколоться иглой.
На конце иглы может появиться капля раствора. Это нормальное явление, однако, Вы все равно должны проверить поступление препарата, если Вы используете новую шприц-ручку в первый раз (см. операцию 2 "Проверка поступления препарата").
Не присоединяйте новую иглу до тех пор, пока Вы не будете готовы сделать инъекцию.
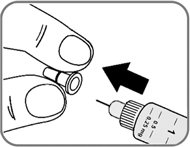
Рис.6
Всегда для каждой инъекции используйте новую иглу.
Это может предотвратить закупорку игл, загрязнение, инфицирование и введение неправильной дозы препарата.
Никогда не используйте иглу, если она погнута или повреждена.
2. Проверка поступления препарата
- Перед первой инъекцией с помощью каждой новой шприц-ручки проверьте поступление препарата. Если шприц-ручка уже находится в использовании, то перейдите к операции 3 "Установка дозы".
- Поворачивайте селектор дозы, пока счетчик дозы не поравняется с символом проверки поступления препарата (рис. 7).
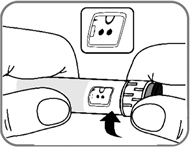
рис. 7
- Держите шприц-ручку иглой вверх.
Нажмите пусковую кнопку и удерживайте ее в этом положении, пока счетчик дозы не возвратится к "0" (рис. 8). "0" должен стоять напротив указателя дозы.
На конце иглы должна появиться капля раствора.
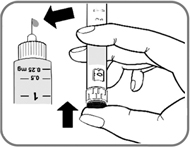
Рис. 8
На конце иглы может оставаться маленькая капля, но она не будет введена при инъекции. Если капля раствора на конце иглы не появилась, повторите операцию 2 "Проверка поступления препарата", но не более 6 раз. Если капля раствора так и не появилась, поменяйте иглу и повторите операцию 2 "Проверка поступления препарата" еще раз. Если капля раствора так и не появилась, утилизируйте шприц-ручку и используйте новую.
Всегда перед использованием новой шприц-ручки в первый раз убедитесь в том, что на конце иглы появилась капля раствора. Это гарантирует поступление препарата.
Если капля раствора не появилась, препарат не будет введен, даже если счетчик дозы будет двигаться. Это может указывать на то, что игла закупорена или повреждена.
Если Вы не проверите поступление препарата перед первой инъекцией с помощью каждой новой шприц-ручки, Вы можете не ввести необходимую дозу и ожидаемый эффект препарата Инсудайв® Слим не будет достигнут.
3. Установка дозы
- Поворачивайте селектор дозы до тех пор, пока он не покажет необходимую Вам дозу.
Ниже на рис. 9 приведен пример, как установить дозу 0.25 мг.
Если доза была выбрана неправильно, Вы можете поворачивать селектор дозы вперед или назад, пока не будет установлена правильная доза.
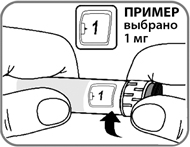
Рис. 9
Селектор дозы изменяет дозу. Только счетчик дозы и указатель дозы покажут количество мг препарата в выбранной Вами дозе.
При каждом повороте селектора дозы раздаются щелчки, звук щелчков зависит от того, в какую сторону вращается селектор дозы: вперед, назад или если набранная доза превышает количество мг препарата, оставшихся в шприц-ручке. Не считайте щелчки шприц-ручки.
Всегда перед каждой инъекцией по счетчику дозы и указателю дозы проверяйте, что была набрана нужная доза.
Выбранная доза должна находиться точно напротив указателя дозы, такое положение гарантирует, что Вы получите правильную дозу препарата.
Сколько препарата осталось
- Чтобы определить, сколько препарата осталось, используйте счетчик дозы (рис. 10): поворачивайте селектор дозы до остановки счетчика дозы. Если он показывает "1", в шприц-ручке осталось не менее 1 мг препарата. Если счетчик дозы остановился до того, как появилась цифра "1", то это означает, что в шприц-ручке осталось недостаточное количество препарата, чтобы ввести полную дозу 1 мг.
Если он показывает "0.5", в шприц-ручке осталось не менее 0.5 мг препарата.
Если счетчик дозы остановился до того, как появилось "0.5", то это означает, что в шприц-ручке осталось недостаточное количество препарата, чтобы ввести полную дозу 0.5 мг.
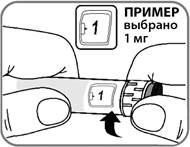
Рис. 10
Если в шприц-ручке осталось недостаточное количество препарата для введения полной дозы, не используйте шприц-ручку. Используйте новую шприц-ручку Инсудайв® Слим.
4. Введение препарата
- Введите иглу под кожу, используя технику инъекций, рекомендованную врачом или медсестрой (рис. 11).
- Убедитесь, что счетчик дозы находится в поле Вашего зрения. Не дотрагивайтесь до счетчика дозы пальцами, это может прервать инъекцию.
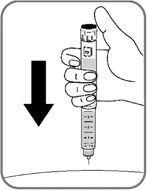
Рис. 11
- Нажмите пусковую кнопку до упора и удерживайте ее в этом положении, пока счетчик дозы не покажет "0" (рис. 12). "0" должен находиться точно напротив указателя дозы. При этом Вы можете услышать или ощутить щелчок.
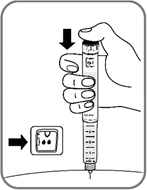
Рис. 12
- Удерживайте иглу под кожей после того, как счетчик дозы вернулся к "0", и медленно считайте до 6 (рис. 13). Это обеспечит введение полной дозы препарата.
- Если Вы извлечете иглу из-под кожи раньше, Вы можете увидеть, как препарат вытекает из иглы. В этом случае будет введена неполная доза препарата.
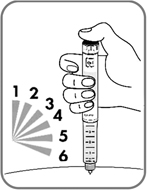
Рис. 13
- Извлеките иглу из-под кожи (рис. 14). Если в месте инъекции появилась кровь, слегка прижмите к месту укола ватный тампон. Не массируйте место укола.
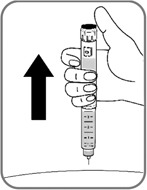
Рис. 14
После завершения инъекции Вы можете увидеть каплю раствора на конце иглы. Это нормально и не влияет на дозу препарата, которую Вы ввели.
Всегда сверяйтесь с показаниями счетчика дозы, чтобы знать, какое количество мг препарата Вы ввели. Удерживайте пусковую кнопку до тех пор, пока счетчик дозы не покажет "0".
Как выявить закупорку или повреждение иглы
- Если после долгого нажатия на пусковую кнопку на счетчике дозы не появляется "0", это может означать закупорку или повреждение иглы.
- В этом случае Вы не получили препарат, даже если счетчик дозы изменил положение с исходной дозы, которую Вы установили.
Что делать с закупоренной иглой
Замените иглу, как описано в операции 5 "После завершения инъекции" и повторите все шаги, начиная с операции 1 "Подготовка шприц-ручки с новой иглой к использованию".
Убедитесь, что установили полную необходимую Вам дозу. Никогда не дотрагивайтесь до счетчика дозы во время введения препарата. Это может прервать инъекцию.
5. После завершения инъекции
- Положив наружный колпачок иглы на плоскую поверхность, введите конец иглы внутрь колпачка, не касаясь его или иглы (рис. 15).
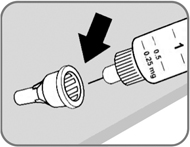
Рис. 15
- Когда игла войдет в колпачок, осторожно наденьте наружный колпачок на иглу (рис. 16).
- Отвинтите иглу и выбросьте ее, соблюдая меры предосторожности и местные требования по утилизации. Проконсультируйтесь с врачом, медсестрой или фармацевтом, как утилизировать острые медицинские отходы.
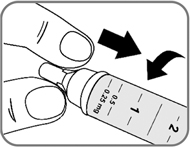
Рис. 16
После каждого использования надевайте на шприц-ручку колпачок, чтобы защитить содержащийся в ней раствор от воздействия света (рис. 17).
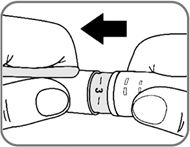
Рис. 17
Всегда после каждой инъекции выбрасывайте иглу, чтобы обеспечить комфортную инъекцию и избежать закупорки игл. Если игла закупорена, Вы не введете себе препарат. Выбрасывайте пустую шприц-ручку с отсоединенной иглой в соответствии с рекомендациями, данными врачом, медсестрой, фармацевтом или в соответствии с местными требованиями.
Никогда не пытайтесь надеть внутренний колпачок обратно на иглу. Вы можете уколоться.
После каждой инъекции всегда сразу удаляйте иглу со шприц-ручки.
Это может предотвратить закупорку игл, загрязнение, инфицирование, вытекание раствора и введение неправильной дозы препарата.
Дополнительная важная информация
- Всегда храните шприц-ручку и иглы к ней в недоступном для всех, и в особенности для детей, месте.
- Никогда не передавайте свою шприц-ручку и иглы к ней другим лицам.
- Лица, осуществляющие уход за больным, должны обращаться с использованными иглами с особой осторожностью, чтобы предотвратить уколы иглой и перекрестное инфицирование.
Уход за шприц-ручкой
Аккуратно обращайтесь со шприц-ручкой. Небрежное обращение или неправильное использование могут привести к введению неправильной дозы препарата. Если это произойдет, Вы не получите ожидаемого эффекта от применения препарата.
- Не применяйте препарат Инсудайв® Слим, если он был заморожен. В этом случае ожидаемый эффект от применения препарата не будет достигнут.
- Не применяйте препарат Инсудайв® Слим, если он подвергся воздействию прямых солнечных лучей. В этом случае ожидаемый эффект от применения препарата не будет достигнут.
- Предохраняйте шприц-ручку от попадания на нее пыли, загрязнений и жидкости.
- Не мойте шприц-ручку, не погружайте ее в жидкость и не смазывайте ее. При необходимости шприц-ручку можно очищать влажной тканью, смоченной мягким моющим средством.
- Нельзя ронять или ударять шприц-ручку о твердую поверхность. Если Вы уронили шприц-ручку или сомневаетесь в ее исправности, присоедините новую иглу и проверьте поступление препарата перед тем, как сделать инъекцию.
- Не пытайтесь повторно заполнить шприц-ручку. Пустую шприц-ручку необходимо выбросить.
- Не пытайтесь самостоятельно починить шприц-ручку или разобрать ее на части.
- Нет особых требований к утилизации.
Побочное действие
В четырех клинических исследованиях (КИ) 3а фазы 2650 взрослых пациентов получали лечение семаглутидом 1 раз в неделю. Продолжительность исследований составила 68 недель. Наиболее частыми НР, о которых сообщалось, были желудочно-кишечные расстройства, включая тошноту, рвоту, диарею и запор. НР, классифицированные по органам и системам, перечислены ниже в порядке убывания частоты возникновения: очень часто (≥1/10), часто (≥1/100, но <1/10), нечасто (≥1/1000, но <1/100), редко (≥1/10000, но <1/1000), очень редко (<1/10000), частота неизвестна (на основании имеющихся данных оценить невозможно).
Таблица 8. Нежелательные реакции, зарегистрированные в ходе контролируемых исследований 3а фазы у взрослых пациентов
| Очень часто | Часто | Нечасто | Редко | Частота неизвестна |
| Со стороны иммунной системы | ||||
| - | - | Гиперчувствительность | Анафилактические реакции | - |
| Со стороны обмена веществ | ||||
| - | Гипогликемия у пациентов с СД2а | - | - | - |
| Со стороны нервной системы | ||||
| Головная больb | Головокружениеb | Дисгевзия | - | - |
| Со стороны органа зрения | ||||
| - | Диабетическая ретинопатия у пациентов с СД2а | - | - | - |
| Со стороны сердца | ||||
| - | - | Увеличение ЧССa,c | - | - |
| Со стороны сосудов | ||||
| - | - | Артериальная гипотензия Ортостатическая гипотензия | - | - |
| Со стороны ЖКТ | ||||
| Рвотаa, b Диареяa, b Запорa, b Тошнотаa, b Боль в животеb, c | Гастритb, c Гастроэзофагеальная рефлюксная болезньb Диспепсияb Отрыжкаb Метеоризмb Вздутие животаb | Острый панкреатитa Задержка опорожнения желудка | - | Кишечная непроходимость |
| Со стороны печени и желчевыводящих путей | ||||
| - | Холелитиазa | - | - | Холангит Холестатическая желтуха |
| Со стороны кожи и подкожных тканей | ||||
| - | Выпадение волосaa | - | Ангионевротический отек | - |
| Общие нарушения и реакции в месте введения | ||||
| Усталостьb, c | Реакции в месте инъекцииc | - | - | - |
| Лабораторные и инструментальные данные | ||||
| - | - | Увеличение амилазыc Увеличение липазыc | - | - |
a см. описание отдельных нежелательных реакций ниже
b наблюдается преимущественно в период повышения дозы
c сгруппированные предпочтительные термины
Описание отдельных нежелательных реакций
Нежелательные реакции со стороны ЖКТ
В течение 68-недельного периода исследования тошнота наблюдалась у 43.9% пациентов, получавших семаглутид (16.1% в группе плацебо), диарея – у 29.7% (15.9% в группе плацебо) и рвота – у 24.5% (6.3% в группе плацебо). Большинство реакций были легкой или умеренной степени тяжести и кратковременными. Запор возник у 24.2% пациентов, получавших семаглутид (11.1% в группе плацебо), был легкой или умеренной степени тяжести и продолжался дольше. У пациентов, получавших семаглутид, средняя продолжительность тошноты составила 8 дней, рвоты – 2 дня, диареи – 3 дня и запора – 47 дней.
Пациенты с умеренной почечной недостаточностью (рСКФ ≥ 30 мл/мин/1.73 м2) могут испытывать более выраженные НР со стороны ЖКТ при лечении семаглутидом.
Желудочно-кишечные осложнения привели к прекращению лечения у 4.3% пациентов.
Острый панкреатит
Частота подтвержденного острого панкреатита, о котором сообщалось в КИ 3а фазы, составила 0.2% для семаглутида и < 0.1% для плацебо соответственно.
Острая желчнокаменная болезнь/Холелитиаз
Холелитиаз был зарегистрирован у 1.6% и привел к холециститу у 0.6% пациентов, получавших семаглутид. Холелитиаз и холецистит были зарегистрированы у 1.1% и 0.3% пациентов, получавших плацебо соответственно.
Выпадение волос
Сообщалось о выпадении волос у 2.5% пациентов, получавших семаглутид, и у 1.0% пациентов, получавших плацебо. Случаи были в основном легкой степени тяжести, и к завершению терапии большинство пациентов восстанавливались. О выпадении волос сообщалось чаще у пациентов с большей потерей массы тела (≥20%).
Учащенное сердцебиение
В исследованиях 3a фазы у пациентов, получавших семаглутид, наблюдалось среднее увеличение ЧСС на 3 уд./мин по сравнению с исходным средним значением 72 уд./мин. Доля пациентов с учащением пульса по сравнению с исходным уровнем ≥10 уд./мин в любой момент времени во время лечения составила 67.0% в группе семаглутида против 50.1% в группе плацебо.
Иммуногенность
Вследствие потенциальных иммуногенных свойств белковых и пептидных лекарственных препаратов, у пациентов могут появиться антитела к семаглутиду после терапии. Доля пациентов с положительным результатом теста на антитела к семаглутиду в любой момент времени после начала исследования была низкой (2/9%), и ни у одного пациента не было антител, нейтрализующих семаглутид, или антител с нейтрализующим эндогенный ГПП-1 эффектом в конце исследования. Во время лечения высокие концентрации семаглутида могли снизить чувствительность анализов, следовательно, нельзя исключать риск ложноотрицательных результатов. Однако у пациентов с положительным результатом теста на антитела во время и после лечения присутствие антител было временным и не оказывало существенного влияния на эффективность и безопасность.
Гипогликемия у пациентов с СД2
В исследовании STEP 2 клинически значимая гипогликемия наблюдалась у 6.2% (0.1 случая на пациенто-год) пациентов, получавших семаглутид, по сравнению с 2.5% (0.03 случая на пациенто-год) пациентов, получавших плацебо. Гипогликемия при введении семаглутида наблюдалась как при одновременном применении с сульфонилмочевиной, так и без нее. Один эпизод (0.2% испытуемых, 0.002 события/пациенто-год) был зарегистрирован как тяжелый у субъекта, одновременно не получавшего сульфонилмочевину. Риск развития гипогликемии повышался при одновременном применении семаглутида с препаратами сульфонилмочевины.
Диабетическая ретинопатия у пациентов с сахарным диабетом
В 2-летнем клиническом исследовании изучалось применение семаглутида в дозах 0.5 мг/доза и 1 мг/доза по сравнению с плацебо у 3297 пациентов с СД2 с высоким сердечно-сосудистым риском (ССР), длительной продолжительностью сахарного диабета и плохо контролируемым уровнем глюкозы в крови. В этом исследовании подтвержденные случаи осложнений диабетической ретинопатии имели место у большего числа пациентов, получавших семаглутид (3.0%), по сравнению с плацебо (1.8%). Случаи наблюдались у пациентов, получавших инсулин с известной диабетической ретинопатией. Разница в лечении проявилась на ранней стадии и сохранялась на протяжении всего исследования. В исследовании STEP 2 о нарушениях сетчатки сообщили 6.9% пациентов, получавших семаглутид в дозе 2.4 мг 1 раз в неделю, 6,2% пациентов, получавших семаглутид в дозе 1 мг/доза, и 4/2% пациентов, получавших плацебо. Большинство случаев были зарегистрированы как диабетическая ретинопатия (4.0%, 2.7% и 2.7% соответственно) и непролиферативная ретинопатия (0.7%, 0% и 0% соответственно).
Сообщение о подозреваемых нежелательных реакциях
Важно сообщать о подозреваемых нежелательных реакциях после регистрации препарата с целью обеспечения непрерывного мониторинга соотношения "польза-риск" лекарственного препарата. Медицинским работникам рекомендуется сообщать о любых подозреваемых нежелательных реакциях лекарственного препарата через национальные системы сообщения о нежелательных реакциях государств–членов Евразийского экономического союза.
Противопоказания к применению
- повышенная чувствительность к семаглутиду или к любому из вспомогательных веществ, входящих в состав препарата;
- медуллярный рак щитовидной железы в анамнезе, в т.ч. в семейном;
- множественная эндокринная неоплазия (МЭН) 2 типа;
- сахарный диабет 1 типа (СД1);
- диабетический кетоацидоз;
- возраст до 18 лет.
Противопоказано применение препарата Инсудайв® Слим у следующих групп пациентов и при следующих состояниях/заболеваниях в связи с отсутствием данных по эффективности и безопасности или ограниченным опытом применения:
- печеночная недостаточность тяжелой степени;
- терминальная стадия почечной недостаточности (КК < 15 мл/мин);
- хроническая сердечная недостаточность (ХСН) IV функционального класса (в соответствии с классификацией NYHA).
С осторожностью
Препарат Инсудайв® Слим рекомендуется применять с осторожностью у пациентов с почечной недостаточностью, у пациентов с наличием панкреатита в анамнезе, в возрасте 75 лет и старше, у пациентов с легкой и умеренной степенью печеночной недостаточности (см. раздел "Режим дозирования"), при диабетическом гастропарезе.
Применение при беременности и кормлении грудью
Женщины с детородным потенциалом
Женщинам с детородным потенциалом рекомендовано использовать надежные методы контрацепции во время лечения семаглутидом (см. раздел "Лекарственное взаимодействие").
Беременность
Исследования на животных показали репродуктивную токсичность. Данные о применении семаглутида у беременных женщин ограничены. Поэтому семаглутид не должен применяться во время беременности. Если пациентка готовится к беременности, либо беременность уже наступила, терапию семаглутидом необходимо прекратить. Из-за длительного периода полувыведения терапию семаглутидом необходимо прекратить как минимум за 2 месяца до планируемой беременности.
Грудное вскармливание
В исследованиях на животных у лактирующих крыс семаглутид выделялся с молоком.
Нельзя исключить риск для ребенка, находящегося на грудном вскармливании. Семаглутид не следует применять в период грудного вскармливания.
Фертильность
Влияние семаглутида на фертильность у человека неизвестно. Семаглутид не влиял на фертильность самцов крыс. У самок крыс наблюдалось увеличение продолжительности эстрального цикла и незначительное снижение количества овуляций в дозах, связанных со снижением массы тела самки.
Применение при нарушениях функции печени
Применение при нарушениях функции почек
Применение у детей
Применение у пожилых пациентов
Особые указания
Обезвоживание
Применение агонистов ГПП-1Р может быть связано с нежелательными реакциями (НР) со стороны ЖКТ, которые могут вызвать обезвоживание, что в редких случаях может привести к ухудшению функции почек.
Пациенты должны быть проинформированы о возможном риске обезвоживания в связи с НР со стороны ЖКТ и принимать меры предосторожности, чтобы избежать потерю жидкости.
Острый панкреатит
При применении агонистов ГПП-1Р наблюдались случаи развития острого панкреатита (см. раздел "Побочное действие"). Пациенты должны быть проинформированы о характерных симптомах острого панкреатита. При подозрении на панкреатит применение семаглутида следует прекратить.
В случае, если диагноз острого панкреатита подтвердится, применение семаглутида не следует возобновлять. Пациентам с панкреатитом в анамнезе следует соблюдать осторожность.
При отсутствии других признаков и симптомов острого панкреатита повышение активности ферментов поджелудочной железы само по себе не является признаком острого панкреатита.
Холецистит
Лечение семаглутидом может увеличить риск развития холецистита и, как следствие, привести к развитию холангита и холестатической желтухи. Во время лечения семаглутидом следует контролировать симптомы, связанные с развитием холецистита.
Пациенты с СД2
Семаглутид не следует применять в качестве заменителя инсулина у пациентов с СД2.
Семаглутид не следует применять в комбинации с другими препаратами-агонистами ГПП-1Р. Эффективность семаглутида в комбинации с другими агонистами ГПП-1 не оценивалась. Существует повышенный риск развития НР, связанных с передозировкой.
Гипогликемия у пациентов с СД2
Известно, что инсулин и препараты сульфонилмочевины вызывают гипогликемию. У пациентов, получающих семаглутид в комбинации с препаратами сульфонилмочевины или инсулином, может повыситься риск развития гипогликемии. Риск развития гипогликемии можно снизить, уменьшив дозу препаратов сульфонилмочевины или инсулина в начале лечения препаратом Инсудайв® Слим.
Диабетическая ретинопатия у пациентов с СД2
Наблюдался повышенный риск развития осложнений диабетической ретинопатии у пациентов с диабетической ретинопатией, получавших терапию семаглутидом (см. раздел "Побочное действие"). Быстрое улучшение гликемического контроля было ассоциировано с временным ухудшением состояния диабетической ретинопатии, однако при этом нельзя исключать и другие причины. Пациенты с диабетической ретинопатией, получающие семаглутид, должны находиться под постоянным наблюдением и получать лечение в соответствии с клиническими рекомендациями.
Опыт применения семаглутида у пациентов с СД2 с неконтролируемой или потенциально нестабильной диабетической ретинопатией отсутствует. Применение препарата Инсудайв® Слим у таких пациентов не рекомендуется.
Прослеживаемость
Для улучшения прослеживаемости лекарственных препаратов необходимо записывать серии и срок годности партии введенного продукта.
Вспомогательные вещества
Препарат Инсудайв® Слим содержит менее 1 ммоль (23 мг) натрия на 1 дозу, т.е., по сути, не содержит натрия.
Влияние на способность к управлению транспортными средствами и механизмами
Семаглутид не влияет или оказывает незначительное влияние на способность управлять транспортными средствами или работать с механизмами. Однако в период увеличения дозы может возникать головокружение. При возникновении головокружения следует соблюдать осторожность при вождении автомобиля или работе с механизмами.
Пациенты с СД2. При применении семаглутида в комбинации с препаратами сульфонилмочевины или инсулином пациентам следует рекомендовать принимать меры предосторожности во избежание гипогликемии при управлении транспортным средством и работе с механизмами.
Передозировка
Симптомы: передозировка семаглутида может проявиться желудочно-кишечными расстройствами, которые могут привести к обезвоживанию организма.
Лечение: в случае передозировки пациент должен находиться под наблюдением для выявления клинических признаков и начала соответствующего симптоматического лечения.
Лекарственное взаимодействие
Семаглутид задерживает опорожнение желудка и потенциально может влиять на всасывание одновременно принимаемых пероральных лекарственных препаратов.
При применении семаглутида в дозе 2.4 мг клинически значимого влияния на скорость опорожнения желудка не наблюдалось.
Семаглутид следует с осторожностью применять у пациентов, получающих пероральные лекарственные препараты, требующие быстрого всасывания из ЖКТ.
Парацетамол
При оценке фармакокинетики парацетамола во время теста стандартизированного приема пищи было выявлено, что семаглутид задерживает опорожнение желудка. При одновременном применении семаглутида в дозе 1 мг AUC0-60мин и Cmax парацетамола уменьшились на 27% и 23% соответственно. Общая экспозиция парацетамола (AUC0-5ч) при этом не изменялась. При одновременном приеме семаглутида и парацетамола коррекция дозы последнего не требуется.
Пероральные контрацептивные препараты
Не предполагается, что семаглутид снижает эффективность пероральных гормональных контрацептивных средств. При одновременном применении комбинированного перорального гормонального контрацептивного препарата (0.03 мг этинилэстрадиола/0.15 мг левоноргестрела) и семаглутида последний не оказывал клинически значимого влияния на общую экспозицию этинилэстрадиола и левоноргестрела. Экспозиция этинилэстрадиола не была затронута. Наблюдалось увеличение на 20% экспозиции левоноргестрела в равновесном состоянии. Сmax не изменилась ни для одного из компонентов.
Аторвастатин
Семаглутид не изменял системную экспозицию аторвастатина после применения однократной дозы аторвастатина (40 мг). Cmax аторвастатина уменьшилась на 38%. Это изменение было расценено как клинически незначимое.
Дигоксин
Семаглутид не изменял системную экспозицию или Cmax дигоксина после применения однократной дозы дигоксина (0.5 мг).
Метформин
Семаглутид не изменял системную экспозицию или Cmax метформина после применения метформина в дозе 500 мг 2 раза/сут в течение 3.5 дней.
Варфарин и другие производные кумарина
Семаглутид не изменил общую экспозицию или Cmax R- и S-изомеров варфарина после применения однократной дозы варфарина (25 мг). На основании определения МНО клинически значимых изменений фармакодинамических эффектов варфарина также не наблюдалось. Однако после начала лечения семаглутидом у пациентов, принимающих варфарин или другие производные кумарина, рекомендуется частый мониторинг МНО.
Дети
Исследования взаимодействия проведены только у взрослых.
Несовместимость
В связи с отсутствием исследований совместимости, данный лекарственный препарат не следует смешивать с другими лекарственными препаратами.
Условия хранения препарата Инсудайв® Слим
Препарат следует хранить в оригинальной упаковке (картонной пачке) для защиты от света, при температуре от 2° до 8°С (в холодильнике), но не рядом с морозильной камерой. Не замораживать.
Срок годности препарата Инсудайв® Слим
Используемую или переносимую в качестве запасной шприц-ручку с препаратом хранить при температуре не выше 30°С или при температуре от 2 до 8 °С (в холодильнике) в течение 6 недель. Не замораживать. После использования закрывать шприц-ручку.
Условия реализации
Контакты для обращений
АКРИХИН АО (Россия)

|
|
142450 Московская обл., г.о. Богородский, |
X







